Jsou ve vodě vodníci?

autor red. | kategorie Biologie 2. stupeň ZŠ
1 Úkol
1.1 Základní úkoly
1.1.1 Posuďte čistotu vody.
1.1.2 Naberte vzorky vody, pracujte s pracovními listy a změřte rychlost toku řeky.
1.1.3 Změřte kyselost a zásaditost vody.
1.1.4 Pozorujte pod mikroskopem organismy žijící ve vodě.
1.1.5 Porovnejte slanou a sladkou vodu.
1.1.6 Upravte pH různých vzorků vody.
2 Čas
2.1 Základní časová dotace: 8–19 hodin dle možností
Teoretická příprava: 7–8 hodin
Praktická příprava: 6–12 hodin
3 Pomůcky a materiál
3.1 Posouzení čistoty vody
Pracovní listy, lupy, nádobky s lupou, psací potřeby
3.2 Práce se vzorkem vody a měření rychlosti toku řeky
Klíč k určování rostlin, bezobratlých živočichů, pH papírky, pracovní list, měřicí pásmo na minimálně 10 metrů, PET lahev 0,5 l, provázek nebo silonové vlákno, případně křída, stopky
3.3 Kyselost a zásaditost vody
Stojánek se zkumavkami (počet podle počtu vzorků vody), lakmusový papírek, univerzální indikátorový papírek, vzorky vody (minerální voda – různé druhy, voda z kohoutku, dešťová voda, voda říční, voda z rybníka nebo tůňky, voda ze zahradního jezírka, voda z praní…)
3.4 Pozorování mikroorganismů pod mikroskopem
Vzorek vody, přehled korýšů, mikroskop, podložní a krycí sklíčko, kapátko
3.5 Slanost vody
Brčko, plastelína, dvě stejně uříznuté PET lahve, voda, kuchyňská sůl
3.6 pH různých vzorků vody
Manganistan draselný, pentahydrát síranu měďnatého, heptahydrát síranu železnatého, dodekahydrát síranu hlinitého, dodekahydrát síranu hlinitodraselného, 5 odměrných baněk na 100 nebo 50 ml, skleněná tyčinka, váhy, hodinová skla, Petriho misky, univerzální indikátorové papírky, kádinky 50 nebo 100 ml, podložní sklíčka, krycí sklíčka, pipety nebo kapátka, lupy nebo mikroskopy, stojánky na zkumavky, odměrný válec na 10 nebo 20 ml
4 Hlavní a dílčí cíle
4.1 Základní cíle
4.1.1 Odvodit a porovnat na základě různých souvislostí čistotu vzorků vody.
4.1.2 Navrhnout postup čištění, změny a úpravy pH vody.
4.2 Vedlejší cíle
4.2.1 Naučit se pracovat s laboratorní technikou.
4.2.2 Umět pojmenovávat chemické sklo.
4.2.3 Posoudit koncentraci vybraných roztoků podle intenzity zbarvení.
5 Mezipředmětové vztahy a přesahy
Materiál svým rozsahem přesahuje náplň předmětu biologie. Pracovní činnosti zasahují do chemie (práce s roztoky, chemikáliemi, chemickým sklem a pH), fyziky (měření rychlosti průtoku vody), výtvarné výchovy (zaznamenávání barevných změn pH) a ekologie (vzájemné vztahy mezi životním prostředím, rostlinami a živočichy).
6 Obecný úvod k tématu
Život na Zemi nejspíš vznikl ve vodním prostředí (ve vodném roztoku). Voda je nejvýznamnější sloučeninou na naší planetě. Objevuje se ve třech skupenstvích v různé kvalitě a čistotě. Naším úkolem bude během těchto cvičení zjistit, která voda je vhodná pro život a jak na změnu vody reagují organismy.
Čistá voda je neutrální. To zjednodušeně znamená, že není ani kyselá ani zásaditá. Ke zjištění kyselosti a zásaditosti roztoků se používají různé indikátory. Jsou to látky, které mění barvu v závislosti na hodnotě tzv. pH. To je číslo od 0 do 14, které vyjadřuje povahu roztoků. Hodnota pH neutrálních roztoků je 7, roztoky s pH menším než 7 jsou kyselé, a pokud je pH větší, jedná se o roztok zásaditý. Většině organismů vyhovuje neutrální nebo slabě kyselé prostředí. Pokud se jedinci (druhu) změní pH, zahyne, živoří nebo uteče.
Voda v našem životním prostředí má různé vlastnosti a kvalitu, která je dána mnoha faktory. Pro živé organismy jsou tyto vlastnosti a kvalita vody velmi důležité. Při hospodaření s vodou se člověk snaží některé vlastnosti vody změnit. K úpravě vody se používají různé látky (nejznámější je asi chlor a ozón). K možným činidlům pro úpravu vody patří např. manganistan draselný a některé sírany: měďnatý, železnatý, hlinitý a hlinitodraselný. Každá skupina látek při čištění funguje jinak. Některé látky fungují jako oxidační činidlo, některé proti živým organismům nebo jejich vývojovým stádiím, jiné látky účinkují jako vločkovače atd.
7 Pracovní postup
7.1 Posuďte čistotu vody.
- Naberte vzorek vody do nádobky s lupou a do pracovních listů zapište živočichy a rostliny, které jste určili.
- Pomocí pracovního listu určete čistotu vody.
7.2 Naberte vzorky vody, pracujte s pracovními listy a změřte rychlost toku řeky.
- Jděte k nejbližšímu potoku, řece nebo rybníku.
- Do nádobky s lupou naberte vzorek vody.
- Prohlédněte si organismy v nádobce a zapište do pracovních listů.
- Poté změřte v nádobce pH vody pomocí pH papírku a zapište.
- Určete podle klíče rostliny a živočichy z okolí rybníka, potoka či řeky.
- Zapište, jaké je počasí, změřte denní teplotu.
- Na závěr změřte průtok toku vody a pokuste se určit typ rybího pásma.
7.2.1 Měření rychlosti průtoku vody
- Podél vodního toku naměřte úsek v délce 10–100 metrů, čím delší, tím větší přesnost měření.
- Navažte provázek (silon) na hrdlo prázdné a zavřené PET lahve.
- Provázek volně uchopte do ruky.
- Délku provázku upravte podle vzdálenosti od koryta toku.
- V počátečním bodě 0 ponořte lahev do proudu a jděte, případně běžte na konec měřeného úseku.
- Provázek musí být neustále povolený a měřte čas, za který lahev proplula vyměřený úsek.
7.3 Změřte kyselost a zásaditost vody.
- Do zkumavek nalijte po 5 ml vody a minerálek. Ty nalévejte z čerstvě otevřených lahví, než vyprchá oxid uhličitý!
- Z každé zkumavky pipetou přeneste kapku vody na indikátorové papírky, nechte vodu vsáknout a pozorujte, jakou získají barvu.
- Změny zaznamenejte. Vzorky vody ve zkumavkách nechte k dalšímu zkoumání.
- Závěr: Ve vodě z vodovodu se papírky nezměnily, v některé z minerálek zmodraly, je to tedy voda , v jiné zrůžověly, jedná se o .... vodu. Voda dešťová je mírně kyselá, voda z praní je zásaditá.
7.3.1 Voda kyselá a zásaditá
- Postup opakujte poté, co vyprchají bublinky oxidu uhličitého z minerálek, to můžete urychlit např. tím, že zkumavky ohřejete. V tabulce výsledky obou testů porovnejte.
- Závěr: V minerální vodě se někdy hodnota pH mění v závislosti na množství oxidu uhličitého, který je v ní rozpuštěný. Jeho rozpustnost je závislá na teplotě a tlaku. Čím nižší teplota a vyšší tlak, tím lépe se oxid uhličitý ve vodě rozpouští.
7.4 Pozorujte pod mikroskopem organismy žijící ve vodě.
- Přineste vzorek vody z rybníka.
- Přeneste kapátkem vzorek vody na podložní sklíčko, zakryjte krycím sklíčkem a sledujte pod mikroskopem v procházejícím světle při malém zvětšení.
- Postupně zvyšujte zvětšení.
- Zakreslujte, co vidíte a pomocí přehledu korýšů určete korýše a charakterizujte čistotu vody.
7.5 Porovnejte slanou a sladkou vodu.
- Na jeden konec brčka upevněte kuličku plastelíny.
- Ponořte brčko do uříznuté PET lahve s běžnou vodou tak, aby se vznášelo na vodě kolmo k její hladině a na jeho spodním konci byla plastelínová kulička.
- Označte na brčku místo, kam dosahovala hladina vody.
- Nyní postup zopakujte se slanou vodou.
- Závěr: Částice hustší kapaliny jsou větší nebo jsou jejich vzdálenosti menší, než je tomu u méně hustých kapalin. Hustší kapaliny tak vytvářejí větší tlak na předměty na hladině. V případě Mrtvého moře vytváří velice slaná a hustá voda vyšší tlak na plavce, kteří se tak nepotopí.
7.6 Upravte pH různých druhů vody.
7.6.1 Příprava, pozorování fyzikálních vlastností a měření pH vzorků vody
- Vzorky vody z různých zdrojů nalijte do čistých kádinek, které předem vypláchnete v destilované vodě nebo v odstáté vodě z kohoutku. Zaměřte se na sledování fyzikálních (smysly vnímatelných) vlastností vody: barva, zápach, zákal, průhlednost, případný pohyb organismů.
- Vepište tyto vlastnosti do tabulky (tab. 1) a vodu v kádinkách překryjte pro další pozorování hodinovým sklíčkem.
- Po chvilce odlijte asi 15 ml vody (15 cm na výšku zkumavky) z každé kádinky do zkumavky. Vyjměte proužek univerzálního indikátorového papírku (dále UIP) a namočte do vzorku vody ve zkumavce tak, abyste si nenamočili prsty.
- Papírek nechte oschnout přes Petriho misku a zaznamenejte přibližnou hodnotu pH do tabulky.
Tab. 1 Výsledky pozorování fyzikálních vlastností vody a měření pH vzorků vody.
Pracovní skupina:
|
Vzorky vody |
|||||
|
barva |
|||||
|
zápach |
|||||
|
zákal |
|||||
|
průhlednost |
|||||
|
pohyb organismů |
|||||
|
pH vody |
7.6.2 Příprava roztoků k úpravě vody (dále činidel) a měření pH s kapkovým množstvím
- V naší práci použijte látky, o kterých je zmínka v úvodu: KMnO4, CuSO4·5H2O, FeSO4·7H2O, Al2(SO4)3·12H2O a KAl(SO4)2·12H2O. Seznamte se s krystalickými solemi, které vám v zásobní lahvičce ukáže vyučující (obr. 1), a jejich barvu zaznamenejte do tabulky.
- Vyučující připraví roztoky všech solí v koncentraci 0,1M o objemu 50 nebo 100 cm3. Roztoky seřaďte a zaznamenejte jejich barvu do tabulky (tab. 2).
- Ve skupinách po 4–5 žácích odlijte vzorky z kádinek po 15 ml do zkumavek a přidejte kapátkem 10 kapek připraveného činidla.
- Zkumavku protřepte a opět změřte pH pomocí UIP.
- Hodnoty pH zaznamenejte do tabulky (tab. 3) a poznamenejte si barvu roztoků.
Obr. 1 Připravená činidla o koncentraci 0,1 M. Foto Mgr. Hana Sloupová
Tab. 2 Barvy roztoků solí.
Pracovní skupina:
|
roztoky solí |
KMnO4 |
CuSO4 ·5H2O |
FeSO4 ·7H2O |
Al2(SO4)3 ·12H2O |
KAl(SO4)2 ·12H2O |
|
barva |
Tab. 3 Hodnoty pH a barva roztoků solí.
Pracovní skupina:
vzorek vody + 10 kapek činidla:
|
vzorek s přidaným KMnO4 |
vzorek s přidaným CuSO4 ·5H2O |
vzorek s přidaným FeSO4·7H2O |
vzorek s přidaným Al2(SO4)3·12H2O |
vzorek s přidaným KAl(SO4)2·12H2O |
|
|
pH roztoku |
|||||
|
barva roztoku |
7.6.3 Úprava koncentrace činidel
Protože roztoky o koncentraci 0,1M jsou pro úpravu vody nevhodné, musíte je naředit na použitelnou koncentraci. Máte k tomu několik možností. U barevných roztoků se můžete řídit změnou barvy roztoku. Při ředění se barva roztoku stává světlejší, až zůstane roztok bezbarvý, to ovšem neznamená, že neobsahuje už žádnou rozpuštěnou sůl. Tomuto způsobu sledování koncentrace se říká kolorimetrie a je možné ho použít i v případě, že nemáte k dispozici žádné odměrné sklo nebo váhy (obr. 2).
U všech roztoků, včetně těch bezbarvých, můžete ředit přidáním určitého konkrétního objemu rozpouštědla. Původní roztok tak bude vůči naředěnému v určitém poměru. Např. když k 1ml koncentrovanějšího roztoku přidáme 5 ml rozpouštědla, bude poměr ředění 1 : 5 apod. Když totéž vyjádříte v molární koncentraci a k 1M roztoku přidáte desetinásobek rozpouštědla, vznikne roztok 0,1M.




Obr. 2 Ředění roztoku podle změny barvy. Foto Mgr. Hana Sloupová
Vyzkoušejte obě varianty:
K destilované nebo odstáté vodě z kohoutku v kádince nebo zkumavce přidáte kapátkem roztoky KMnO4, CuSO4·5H2O a FeSO4·7H2O, tedy činidel, z nichž každé má svoji typickou barvu. Přidávejte postupně takové množství činidla, až se barva projeví náznakem (posuzujte na bílém pozadí, např. na čtvrtce). Máte tedy k dispozici lehce narůžovělý, namodralý a nažloutlý roztok (obr. 3). Z bezbarvých roztoků hlinitých solí odeberte stejné množství do kádinek. Roztoky v kádinkách zůstanou logicky bezbarvé. Pak opět změřte pH a hodnoty zaznamenejte do tabulky (tab. 4). Vzniklé roztoky uchovejte k dalšímu postupu.
KAl(SO4) 2·12H2O/ CuSO4·5H2O / FeSO4·7H2O / KMnO4 /Al2(SO4)3·12H2O
Obr. 3 Ředění roztoků z podkapitoly 7.6.3 a). Foto Mgr. Hana Sloupová
Tab. 4 Hodnoty pH a barva roztoků solí.
Pracovní skupina:
|
vzorek s přidaným KMnO4 |
vzorek s přidaným CuSO4 ·5H2O |
vzorek s přidaným FeSO4 ·7H2O |
vzorek s přidaným Al2(SO4)3·12H2O |
vzorek s přidaným KAl(SO4)2·12H2O |
|
|
pH roztoku |
|||||
|
barva roztoku |
a) K 1 ml roztoku hlinitých solí přidejte nejprve 10 ml vzorku vody, promíchejte a změřte pH. Poté přidejte ještě 90 ml vzorku vody, opět promíchejte a změřte pH. Naměřené hodnoty zaznamenejte do tabulky (tab. 5). Vzniklé roztoky uchovejte k dalšímu postupu.
Tab. 5 Hodnoty pH roztoků hlinitých solí.
Pracovní skupina:
|
s Al2(SO4)3·12H2O |
s KAl(SO4)2·12H2O |
|
|
pH roztoku s 10 ml vzorku vody |
||
|
pH roztoku s 90 ml vzorku vody |
7.6.4 Vliv činidel na život organismů
- Pokud jste v některém vzorku zjistili nějaký pohyb organismů, připravte si podložní a krycí sklíčko a mikroskop nebo lupu.
- Na podložní sklíčko kápněte kapátkem nebo pipetou malou kapku vody a opatrně ji překryjte krycím sklíčkem.
- Pokud máte lupu, zkuste zjistit, zda je pod sklíčkem pohyb organismů. Pokud ne, postup opakujte.
- Pak vložte sklíčko pod mikroskop, naberte do pipety činidlo z kapitoly 7.6.3. a přiložením pipety k okraji sklíčka přeneste činidlo pod sklíčko (obr. 4).
- Sledujte směr a intenzitu pohybu organismů.
Směr pohybu organismů je od přidávaného roztoku. Pokud je organismus v kontaktu s chemikálií, která jej ohrožuje, snaží se utéct co nejdále od jejího zdroje. Tomuto jevu se říká negativní chemotaxe.
Obr. 4 Aplikace činidla pipetou pod krycí sklíčko. Kresba Mgr. Hana Sloupová
8 Metodické poznámky
Dělení jiných korýšů (obr. 5):
I. Buchanky – pohyb pomocí hrudních nožek, potrava: bakterie, prvoci nebo cizopasí
- buchanka (samice nosí 2 váčky vajíček)
- vznášivka (samička má pod zadečkem 1 váček s vajíčky)
II. Stejnonožci
- berušky – žijí ve vodě
- stínky – souš (nestahují se do kuličky)
- svinky – souš (stahují se do kuličky)
III. Různonožci – žijí pouze v čistých vodách
- blešivci
IV. Lupenonožci – mm rozměry
- perloočky – stojaté vody, potrava: drobné organismy
- listonozi – 7 cm velcí, živí se dravě, v dočasných tůňkách, kalužích, při znečištění hynou
V. Žábronožky – žijí v dočasných tůňkách a loužích, plavou hřbetem dolů, jejich vajíčka vydrží v bahně 3 až 5 let, při znečištění hynou
Perloočky + buchanky → součástí planktonu


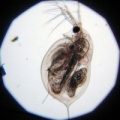
beruška vodní blešivec obecný hrotnatka průhledná


listonoh jarní stínka obecná


vznášivka obecná žábronožka letní
Obr. 5 Obrázky zástupců korýšů.
Rybí pásma:
I) pstruhové – chladná, čistá voda, velké množství kyslíku
II) lipanové – relativně čistá voda, teplejší (Otava)
III) parmové – tažné vody, nižší množství kyslíku, ještě čisté
IV) cejnové – pomalu tekoucí voda, bahnité dno (Berounka)
9 Použitá literatura a další zdroje
Čabradová, V., Hasch, F., Sejpka, J., Vaněčková, I. 2003. Přírodopis 6. Fraus. Plzeň.
Dobroruka, L., Cílek, V., Hasch, F., Storchová, Z. 1997. Přírodopis 6. Scientia. Brno.
Senčanski, T. 2012. Malý vědec. Edika. Brno.
Zdroje obrázků:
Žábronožka letní: http://commons.wikimedia.org/wiki/File:Branchipus-schaefferi.jpg
Listonoh jarní: http://commons.wikimedia.org/wiki/File:LepidurusApus.jpg
Hrotnatka průhledná. http://commons.wikimedia.org/wiki/File:Daphnia_fg01.jpg
Vznášivka obecná. http://commons.wikimedia.org/wiki/File:Eudiaptomus_vulgaris.jpg
Blešivec obecný: http://commons.wikimedia.org/wiki/File:Gammarus_roeselii.jpg
Beruška vodní: http://commons.wikimedia.org/wiki/File:Asellus_alaskensis_lateral_view.jpeg
Stínka. http://commons.wikimedia.org/wiki/File:Oniscus_asellus_-_female_top_1_(aka).jpg







 Pracovní listy
Pracovní listy

Poslední komentáře