Bakterie - jak uvidět neviditelné

autor red. | kategorie Biologie Střední škola
1 Úkol
1.1 Základní úkoly
1.1.1 Kultivujte bakteriální kolonie na různých živných půdách.
1.1.2 Pouhým okem pozorujte kultivované kolonie bakterií.
1.2 Fakultativní úkoly
1.2.1 Vytvořte mikroskopické preparáty různých bakterií a pozorujte pod mikroskopem.
1.2.2 Izolujte čisté bakteriální kultury a pěstujte je na šikmých agarech.
1.2.3 Zjistěte početnost bakteriální biomasy z různých vzorků.
2 Časová dotace
2.1 Základní časová dotace: 5 hodin
teoretická příprava: 1 × 1 hodina
praktická příprava (roztoky, sklo): 1 × 2 hodiny
kultivace bakterií: 1 × 1 hodiny
pozorování kolonií: 1 × 1 hodina
2.2 Fakultativní úkoly: až 6 hodin
barvení a pozorování bakterií: 1 × 2 hodiny
izolace čistých kultur: 1 × 2 hodiny
počítání bakterií: 1 × 2 hodiny
3 Pomůcky a materiál
3.1 Základní pomůcky
Kultivace bakterií: sterilizované[1] sklo (kádinka, 4 zkumavky, 4 Petriho misky), sterilizované[2] živné půdy, živný agar, masopeptonový bujon, hovězí bujon v kostce, NaCl, voda, pomůcky pro var, pomůcky pro vážení, vatové nebo alobalové zátky.
3.2 Pomůcky pro fakultativní úkoly
Barvení a pozorování bakterií: odmaštěná sklíčka (K2Cr2O7, HNO3, voda, saponát, filtrační papír), barvicí roztoky (safranin, Lugolův roztok, krystalová violeť – viz pracovní postup), mikrobiologická klička (platinový nebo měděný drátek na tyčince, na konci s očkem), kahan, filtrační papír, voda, mikroskop (olejová imerze, alespoň 600násobné zvětšení)
Izolace čistých kultur: sterilizované živné půdy (plotny a šikmé agary), mikrobiologická klička, kahan, hokejka (zahnutá skleněná tyčinky), etanol (sterilizace hokejek)
Počítání bakterií: sterilizované živné půdy (plotny a šikmé agary), mikrobiologická klička, kahan, hokejka (zahnutá skleněná tyčinky), etanol (sterilizace hokejek), čistá (převařená) voda
4 Hlavní a dílčí cíle
4.1 Základní cíle
4.1.1 Dokázat existenci bakterií kultivací jejich kolonií a mikroskopicky
4.1.2 Zvládnout základní mikrobiologické techniky
4.2 Vedlejší cíle
4.2.1 Naučit se barvit bakterie dle Grama a rozlišovat bakterie při pozorování mikroskopem na grampozitivní a gramnegativní.
4.2.2 Zvládnout izolaci čistých kultur bakterií.
4.2.3 Zjistit početnost živých bakterií ve vzorku kultury.
5 Mezipředmětové vztahy a přesahy
Tento materiál přesahuje svým obsahem předmět biologie. Významně se prolíná s chemií (práce s chemikáliemi, barvení preparátů, sterilizace), s matematikou (ředění kultur), s medicínou (význam bakterií).
6 Obecný úvod k tématu
6.1 Kultivace baktérií
Bakterie se vyskytují ve společenstvech tvořených mnoha druhy s obrovskou početností. Při studiu konkrétního typu bakterií je nezbytné vytvořit kolonii bakterií pocházejících z jedné jediné buňky. Taková populace jedinců vzniklých vegetativním rozmnožením se v mikrobiologii nazývá čistá kultura. Izolaci a kultivaci bakterií poprvé použil Robert Koch (1843–1910). Koch získal čistou kulturu tak, že jako živné médium použil zpevněné substráty typu agar. Na takových živných půdách se vznik kolonie projeví jako různobarevný okrsek (většinou polokulovitého tvaru) biomasy – bakteriální kolonie.
6.1.1 Aseptická práce
Při izolacích kultur a jejich kultivace je nutno zachovat aseptickou práci, která zahrnuje následující zásady:
- Práce probíhá v čisté místnosti bez průvanu, ve které se nevíří prach.
- Pracujeme vsedě, s předem připravenými pomůckami v dosahu, ideálně ve dvojici.
- Sterilní předměty (zátky, pipety) nesmí být kontaminovány; nesmí být pokládány nebo drženy za konec, který přijde do styku s bakteriální.
- Všechny otevřené nádoby (agary, baňky s půdami, apod.) držíme zásadně šikmo.
- Stejně jako vždy při práci v laboratoři zbytečně nemluvíme, nekašleme a samozřejmě dodržujeme ostatní zásady práce v laboratoři
- Práce musí probíhat efektivně, rychle a přesně – jen tak se vyvarujeme kontaminace.
6.1.2 Živné půdy pro kultivaci bakterií
Existuje celá škála živných půd pro mikroorganismy. Všechny však musí mít obecné vlastnosti, mezi které patří zdroj energie (též vodíku a elektronů), zdroje základních biogenních prvků (uhlíku, dusíku, ostatních biogenních prvků), akceptor elektronů (např. kyslík), růstové faktory, vhodné pH, vhodná teplota.
Příkladem komplexního media může být hydrolyzát kvasinek, hydrolyzát masa (pepton) nebo komplexní masopeptonový bujon.
6.1.3 Vatové zátky
Vatovými zátkami se uzavírají nádoby obsahující sterilizované živné půdy a čisté kultury naočkované na živných půdách. Zajišťují průchod dýchacích plynů a zároveň zabraňují průniku jiných bakterií. Vytváří se z napříč složeného, pevně srolovaného proužku buničité vaty, širokého ve shodě s požadovanou výškou zátky. Pro krátkodobé účely je možno hrdlo nádoby uzavírat i alobalem přehnutým kolem hrdla nádoby.
6.1.4 Sterilizace
Sterilizace je zahubení všeho živého v daném prostředí (např. v baňce, zkumavce). Systém musí být při sterilizaci ovšem uzavřen tak (vatovou zátkou), aby po skončení sterilizace nedošlo k nové kontaminaci z nesterilního okolí. Sterilizaci je možno provádět několika způsoby, např. žíháním v plameni, suchým teplem (sterilizace se provádí v horkovzdušných sterilizátorech 1 hodinu při 160 0C), vodní parou (přičemž sterilizace horkou vodní parou je účinnější než sterilizace suchým teplem). Sterilizujeme tak všechny vodné roztoky a s vodou se mísící kapaliny. Můžeme tak sterilizovat i suché sklo (pipety, misky) i prázdné nádoby uzavřené vatovou zátkou. Vegetativní buňky hynou ve vodě při 100 0C již za několik minut.
6.1.5 Lití ploten
Ze šikmo nakloněné baňky vyjmeme vatovou zátku, krátce v plameni ožehneme hrdlo baňky s tekutou agarovou půdou držené dnem v dlani pravé ruky, ožehneme též vatovou zátku. Jednou rukou opatrně zdvihneme víčko sterilní Petriho misky a vlijeme do ní takové množství agarové půdy, aby vznikla vrstva 3–5 mm tlustá. Nesmí dojít k potřísnění okraje misky. Petriho misku uzavřeme, znovu ožehneme hrdlo baňky i zátku a baňku uzavřeme.
6.1.6 Šikmé agary
Agar přelitý v baňce tekutou půdou rozehřejeme v horké páře a za tepla naplníme do zkumavek do výše 2 až 3 cm. Sterilizujeme a poté necháme utuhnout v šikmé poloze. Dodržujeme opět zásady aseptické práce – v tomto případě nesmí především dojít k potřísnění hrdla zkumavky a vatové zátky.
6.2 Pozorování bakterií pod mikroskopem
Bakteriální buňky nejsou v optickém mikroskopu téměř viditelné, a proto je barvíme. Každé organické barvivo se skládá ze dvou funkčních částí - chromoforu a auxochromu. Chromofor (např. skupina -NO2) uděluje molekule barevnost, auxochrom (např. -OH) jí udělí disociovatelnost.
Barviva jsou obecně dvojího druhu: kyselé barvivo disociuje tak, že barevná část molekuly je aniontem, bazické barvivo tak, že barevná část molekuly je kationtem. Bazické nebo bazofilní barvivo pak baví kyselé struktury v buňce (např. jádro), zatímco kyselé barvivo bazické struktury. V bakteriologii jsou nejdůležitější barviva bazická.
Gramovo barvení je diferenciální barvení. Podle výsledku barvení dělíme bakterie na grampositivní a gramnegativní.
6.2.1 Práce s optickým mikroskopem
Mikroskop se skládá z části optické (objektiv a okulár), osvětlovací (zdroj světla, clona, kondenzor) a mechanické (stativ, stolek, tubus).
Objektiv vytváří převrácený a zvětšený obraz předmětu. Jeho ohnisková vzdálenost kolísá od 20 mm do 1,5 mm. Čím menší ohnisková vzdálenost, tím větší vlastní zvětšení objektivu podle vzorce Z = (/fob)-(250/fok), kde Z je celkové zvětšení, fob a fok jsou ohniskové vzdálenosti okuláru a objektivu, je optická délka tubusu mikroskopu, 250 je normální konvenční zraková vzdálenost lidského oka a f je ohnisková vzdálenost v mm.
Numerická apertura objektivu je charakteristická hodnota daná konstrukcí objektivu, a je uvedena, stejně jako zvětšení, přímo na plášti objektivu. Numerickou aperturu značíme A, lze ji vyjádřit vztahem A = n.sin α, kde α je poloviční otvorový úhel objektivu.
Hloubka ostrosti objektivu je nepřímo úměrná numerické apertuře. Čím silnější objektiv, tím menší hloubka ostrosti. Okulár dále zvětšuje obraz vytvořený objektivem, a to podle konstrukce 5x až 20x. Celkové zvětšení mikroskopu je dáno součinem vlastních zvětšení objektivu a okuláru. Je zbytečné, aby bylo větší než tisícinásobek numerické apertury použitého objektivu.
Bakterie se dobře pozorují pomocí mikroskopu s fázovým kontrastem. Bakterie se při pozorování fázovým kontrastem jeví tak, že jsou tmavé na světlém pozadí.
Obecné zásady při práci s mikroskopem při pozorování bakterií:
- Pozorování se začíná vždy nejmenším zvětšením, barvené preparáty bakterií však pozorujeme pod objektivem zvětšujícím 100× s použitím imerzního oleje.
- Pozorování začínáme sešroubováním tubusu dolů tak, až se objektiv dotkne skla na stolku mikroskopu; při tom se díváme na tubus z boku.
- Zajistíme maximální osvětlení pozorovaného místa, a co nejvíc cloníme.
- Makro šroubem posouváme tubus nahoru dokud nezahlédneme objekt, pak doostříme mikrometrickým šroubem.
- Při použití imerzního objektivu kápneme na suchý preparát malou kapku imerzního (cedrového) oleje a do něho vnoříme objektiv
- Po skončení mikroskopování pozorování imerzní objektiv ihned otřeme do sucha speciálním papírem na čočky nebo velmi jemným čistým sepraným pláténkem s použitím lihu nebo xylenu.
6.3 Izolace čistých kultur
Očkování je přenesení části populace čisté kultury (inokula) do jiné nádoby s živným médiem. Provádí se mikrobiologickou kličkou nebo pipetou.
Mikrobiologická klička musí být před použitím vypálena. Po vypálení se klička nechá na několik vteřin vychladnout nebo ji zchladíme dotykem o sterilní agarovou půdu.
6.4 Počítání bakterií
Počet (koncentraci) živých buněk v kultuře či nějakém vzorku (půda, voda, stolice) můžeme stanovit různými metodami. Často se používá ředění, které zajistí výsev kolonií vzniklých z jediné buňky. Dle známé koncentrace vzniklých kolonií a ředění lze potom odhadnout hustotu bakterií v původním vzorku.
Inkubace při ředění postačí většinou v intervalu 24 – 48 hodin. Kultivační teplota se pohybuje pro mezotermofily v rozmezí 30–37 0C, pro psychrofily 15–25 0C a pro termofily 50–70 0C.
7 Pracovní postup
7.1 Kultivace baktérií
7.1.1 Příprava živných půd
Masopeptonový bujon (resp. jeho pevná forma masopeptonový agar) je klasické živné médium pro bakterie. Skládá se z následujících částí:
- masový extrakt............. 10 g
- pepton........................... 10 g
- NaCl.............................. 5 g
- agarová řasa................. 20 g
- destilovaná voda ad...... 1000 ml
NaCl, masový extrakt a pepton se rozpustí v horké vodě a roztok se následně cca 10 minut vaří. Po ochlazení se doporučuje kontrola pH a případně její upravený na hodnotu pH 7,2 - 7,4. Následně je do roztoku vložen agar, který se rozpustí a pak je celý roztok sterilizován po dobu 20 minut (obr.1).

Obr. 1 Příprava masopeptonového bujonu jako živné půdy (pepton, masový bujon, sůl, agarová řasa). Foto Pavel Vlach
Živný bujon a živný agar jsou průmyslově vyráběny v různých podobách jako hotová média, která se jen rozpustí.
Příprava: 40 g/l vody, za občasného zamíchání nechat nabobtnat agar, pak sterilizovat po dobu 20 minut (obr. 2).

Obr. 2 Příprava živného agaru je velmi jednoduchá (viz text). Foto Pavel Vlach
7.1.2 Příprava vatových zátek
Proužek buničité vaty složíme napříč na požadovanou výšku a pevně jej zavineme. Pro krátkodobé účely je možno hrdlo nádoby uzavírat i alobalem přehnutým kolem hrdla nádoby.
7.1.3 Výroba mikrobiologické kličky
Na drátku o délce cca 5 cm (měděný, platinový) a tloušťce 0,5–1 mm vytvoříme na konci pinzetou malé očko (o průměru cca 2 mm). Na skleněnou tyčinku navlékneme bužírku (např. kousek odstřihnuté gumové hadičky) a dbáme, aby po tyčince neklouzala. Mezi bužírku a tyčinku zastrčíme konec upraveného drátku tak, aby minimálně 3 cm drátku přesahovaly skleněnou tyčinku.
7.1.4 Sterilizace půd a nádobí
- Dle návodu připravíme 500 ml živného (masopeptonového) agaru (viz 7.1.1). Po důkladném promíchání a za horka naplníme 10 zkumavek po asi 8 ml a zazátkujeme vatovou nebo alobalovou zátkou.
- Nepoužité zbytky agarové půdy v baňce uzavřeme vatovou zátkou.
- Zkumavky a agarovou půdu sterilizujeme, šikmé agary po sterilizaci necháme utuhnout v šikmé poloze (obr. 3).
- 10 pipet na 1 ml, 2 pipety na 10 ml dělené a 2 trubičky na Pasteurovy pipety. Konce pipet vkládané do úst uzavřeme smotkem vaty. Pouzdro, 5 chemických zkumavek uzavřených hliníkovou folií a ostatní nádobí vysterilizujeme.

Obr. 3 Odmaštěná skla, sterilní šikmé agary, zbytky živné půdy, nalité naočkované plotny ke kultivaci – základ pro další týden mikrobiologického praktika. Foto Pavel Vlach
7.1.5 Příprava šikmých agarů a ploten[3]
Do 6 sterilních Petriho misek nalijeme horkou sterilní agarovou půdu po asi 15 až 20 ml a necháme utuhnout (obr. 4, 5 a 6). Po zatuhnutí očkujeme na agarové půdy vzorky, ze kterých chceme kultivovat bakterie. Lze doporučit kultivaci z půdy, ze vzduchu, z otisku předmětu nebo kašle, tj. např. na jednu plotnu nasypeme několik zrníček zahradní půdy, 2 plotny otevřeme a necháme odkryté: první 1 minutu, druhou 10 minut, na další plotnu nakašleme, na jinou otiskneme nějaký předmět. Po naočkování do živného média necháme bakterie cca 3-5 dní pomnožit. Běžné bakterie vyrostou při pokojové teplotě, patogenní bakterie kultivujeme při teplotě lidského těla v termostatu.

Obr. 4 Základem mikrobiologické aseptické práce je mimo jiné sterilní nádobí (Petriho misky a zkumavka a šikmé agary opatřené vatovými nebo alobalovými zátkami). Foto Pavel Vlach

Obr. 5 Po sterilizaci živné půdy ihned lijeme plotny do Petriho misek. Foto Pavel Vlach

Obr. 6 Po nalití ploten lijeme šikmé agary. Foto Pavel Vlach
7.2 Pozorování bakterií pod mikroskopem
7.2.1 Čištění podložních skel
V 1000 ml vody rozpustíme 60 g koncentrované HNO3 a 60 g K2Cr2O7. Do roztoku vložíme jednotlivě podložní skla a v digestoři je povaříme. Opláchneme je vodou a povaříme v roztoku saponátu (obr. 7). Poté skla důkladně propereme, opláchneme vodou a usušíme. Suchá vyčištěná skla uchováváme v dóze. Před použitím sklíčko několikrát protáhneme plamenem kahanu.

Obr. 7 Podložní skla je nutno před barvením bakterií dokonale odmastit. Foto Pavel Vlach
7.3 Zhotovení preparátu
- Na dobře vyčištěné podložní sklo protáhnuté plamenem přidáme kapku vody.
- Mikrobiologickou kličkou naneseme z plotny malé množství bakteriální biomasy do připravené kapky vody a rozmícháme na sklíčku v jemně zakalenou suspenzi. Kličkou rozetřeme suspenzi do plochy tak, aby vznikl tenký souvislý film. Ten necháme bez zahřívání na vzduchu uschnout. Posléze fixujeme protažením plamenem kahanu a barvíme dle Grama (obr. 8).
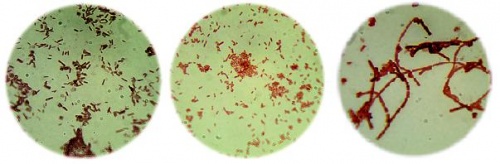
Obr. 8 Mikrofotografie bakterií barvených dle Grama.
7.3.1 Barvení bakterií podle Grama
Nejdříve připravíme barvicí roztoky.
1) Krystalová violeť
Roztok A: krystalová violeť 2 g
ethanol 20 ml
Roztok B: oxalát amonný 0,8 g
destilovaná voda 80 ml
Smíchat oba roztoky.
2) Lugolův roztok
jod 1 g
jodid draselný 2 g
destilovaná voda 300 ml
3) Safranin roztok 0,25 g
ethanol 10 ml
po rozpuštění přidat
destilovanou vodu 100 ml
- Připravený nafixovaný preparát barvíme nejdříve po dobu 90 s krystalovou violetí tak, že na preparát na podložním skle nakapeme barvivo. Podložním sklem v průběhu barvení manipulujeme nejlépe pinzetou, neboť barvivo intenzivně barví.
- Sklíčko opláchneme středně silným proudem vody z vodovodu.
- Na preparát nakapeme Lugolův roztok a necháme působit cca 60 sekund.
- Preparát opět opláchneme a osušíme přežehlením filtračním papírem.
- Osušený preparát oplachujeme 95% etanolem (mírným proudem, nejlépe ze střičky) tak dlouho, dokud masivně odchází barvivo (asi 30 s).
- Preparát pět osušíme filtračním papírem a dobarvujeme 80 s safraninem.
- I po tomto barvení oplachujeme, sušíme filtračním papírem a posléze pozorujeme olejovou imerzí.
7.4 Izolace čistých kultur
Z bakteriálních shluků připravíme čisté kultury tak, že z jednotlivých kupek bakteriálních kolonií přenášíme mikrobiologickou kličkou biomasu na čisté plotny v podobě krátkých čar, přes které po obvodu vedeme křížem jiné čáry (opakuje asi 3×). V posledním úseku budou po kultivaci jen kopečky bakteriálních kolonií, které je možno přenést na šikmé agary.
7.5 Počítání bakterií
Pro počítání bakterií je nutno kulturu bakterií naředit. Bakterie ředíme sterilní vodou sterilními pipetami v poměru 1:10 nebo 1:100 tak, abychom nakonec získali suspense zředěné 10-5, 10-6 a 10-7.
Každé ředění ideálně pipetujeme na 2 mírně vyschlé plotny v množství 0,1 ml. Suspenzi roztíráme na Petriho misce sterilní zahnutou skleněnou tyčinkou („hokejkou“). Po 48 hodinách spočítáme kolonie, přičemž nás zajímá ředění, které dává 20 až 200 kolonií na misce. Pouze na těchto miskách spočítáme vyrostlé kolonie, spočteme průměr a po vynásobíme ředěním stanovíme počet živých bakterií v 1 ml původní kultury.
8 Metodické poznámky
Šíře předkládaných témat a jejich rozsah je samozřejmě možné redukovat podle potřeb a podmínek školy.
Sterilizaci nádobí a živných půd lze samozřejmě provádět i v tlakovém hrnci za dosažení stejných výsledků. Pouze manipulace a prostorové omezení hovoří ve prospěch použití autoklávu. Pokud řešíte jen základní úkoly tohoto tématu, lze v krajním případě od sterilizace upustit (při dokonalé přípravě půd, tj. jejich delšího převaření, při použití dobře a čistě připraveného nádobí). Je nutno počítat, že některé vzorky mohou být znehodnoceny bakteriálním plakem. I přesto lze druhý úkol, tj. barvení a pozorování bakterií mikroskopem, s úspěchem realizovat.
9 Doporučená a použitá literatura
Internetový atlas mikroorganismů. Dostupné z:
<http://www.vscht.cz/obsah/fakulty/fpbt/ostatni/miniatlas/mikr.htm>.
Kaprálek, F. 1999. Mikrobiologické praktikum. Karolinum. Praha.
Kaprálek, F. 2000. Základy bakteriologie. Karolinum. Praha.
Rosypal, S. (ed.) 2003. Nový přehled biologie. Scientia. Praha.
Mikrobiologie pro studenty 3. Lékařské univerzity. Dostupné z:
<http://mikrobiologie.unas.cz/index.html>.
[1] viz metodické poznámky
[2] viz metodické poznámky
[3] Viz metodické poznámky











Poslední komentáře