Příprava kyslíku rozkladem manganistanu draselného
autor red. | kategorie Chemie 2. stupeň ZŠ
1 Příprava kyslíku rozkladem manganistanu draselného
Čas: 15 minut
1.2 Pomůcky a chemikálie
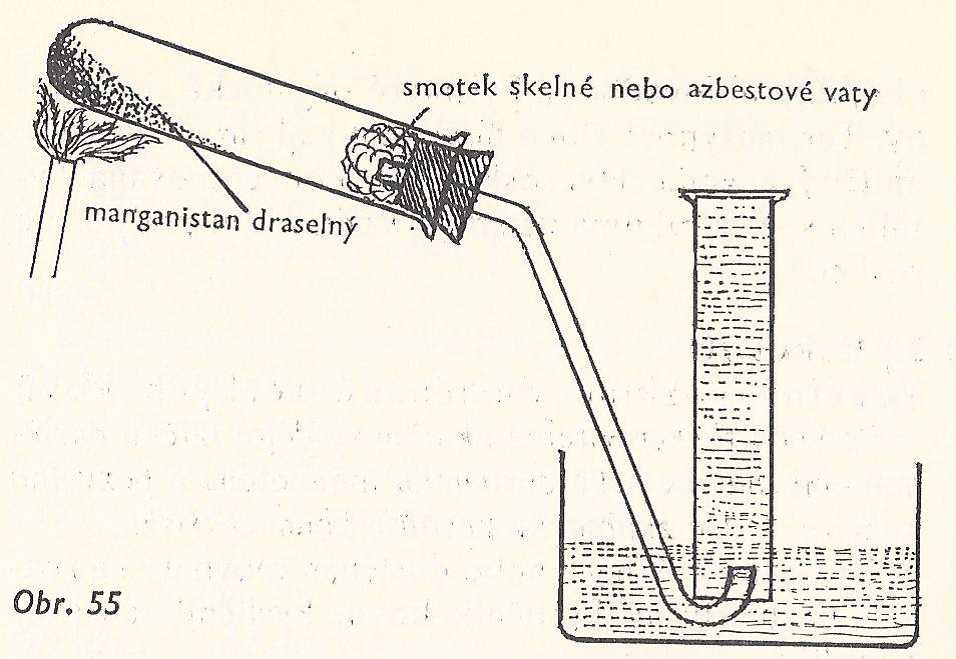
Těžkotavitelná zkumavka, stojan, držák, zátka s otvorem, skleněná trubička ohnutá pro jímání plynu, válec, pneumatická vana, KMnO4, voda, skelná vata.
1.3 Princip
Tepelný rozklad manganistanu draselného při zvýšené teplotě (200 °C).
2 KMnO4 ® K2MnO4 + MnO2 + O2
1.4 Postup
Do těžkotavitelné zkumavky dejte manganistan draselný KMnO4 asi do ¼. Zkumavku upevněte vodorovně do stojanu. Do ústí dejte trochu skelné vaty. Zkumavku uzavřete zátkou s otvorem, kterým prochází ohnutá trubička k jímání plynu nad vodou. Manganistan draselný zahřívejte.
Pozorování: Vznikající bezbarvý plyn prochází trubičkou do válce s vodou, probublává a vyplňuje prostor nad ní. Doutnající špejlí proveďte důkaz, že vzniklý plyn je kyslík.
1.5 Otázky a úkoly pro žáky
1) Jakou barvu a skupenství má KMnO4 a MnO2?
1) K čemu se tyto látky používají?
2) Kolik dm3 kyslíku vznikne za s.p. rozkladem 10 g KMnO4?
1.6 Metodické poznámky
Je nutné použít práškový manganistan draselný a suchou zkumavku.
Při zahřívání manganistanu draselného vzniká kromě plynného kyslíku oxid manganičitý (černý prášek) a manganan draselný (zelený prášek).
Lze provést následný pokus: Produkty rozkladu nasypte do válce s vodou a pozorujte barevné změny. Roztok KMnO4 je fialový, roztok K2MnO4 je zelený.




Poslední komentáře