Hliník, hořčík, zinek, měď – redoxní děje
autor red. | kategorie Chemie 2. stupeň ZŠ
1 Hliník, hořčík, zinek, měď – redoxní děje (demonstrační)
Čas: 30 minut
1.2 Pomůcky a chemikálie
Petriho miska, kleště, kádinky, roztok HCl (w = 5 %), hadřík nebo vata, vzorky kovů, granulky, plíšky nebo hobliny Mg, Zn, Al, roztok CuCl2 (w = 20 %), zpětný projektor.
1.3 Princip
Při substitučních reakcích dochází k náhradě atomů nebo skupin atomů jiným atomem nebo skupinou. Substituční reakce se někdy označují jako vytěsňování. Hlavním úkolem této demonstrační úlohy je ukázat příklady jednoduchých substitučních dějů, vytěsňování ušlechtilého kovu neušlechtilým kovem v souladu s Beketovovou řadou kovů.
1.4 Postup
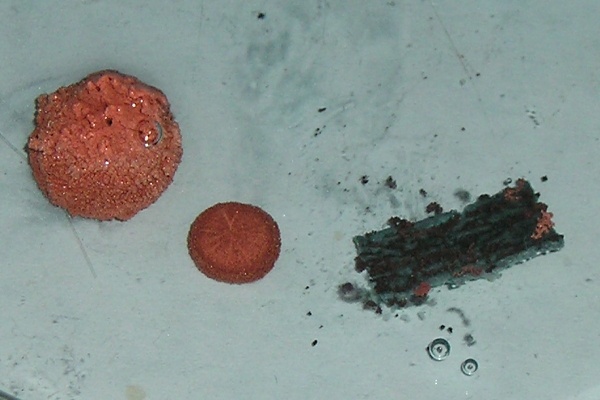
Na zapnutý zpětný projektor položte Petriho misku, přidejte roztok CuCl2 na výšku min. 5 mm. Pomocí kleští ponořte na několik sekund kovy (Al, Zn ) do roztoku HCl a očistěte je hadříkem. Pak ponořte všechny kovy (Al, Zn, Mg) do Petriho misek s nalitým roztokem CuCl2 a pozorujte změny v roztoku a na povrchu kovů v něm ponořených. Po 10 minutách opatrně vyjměte kovy z roztoku, nechte je oschnout a prodiskutujte změnu barvy jejich povrchu a znatelné odbarvení roztoku chloridu měďnatého.
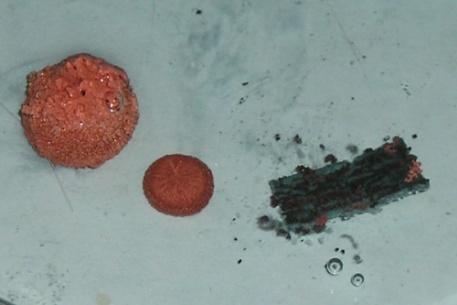
hliník zinek hořčík
1.5 Otázky a úkoly pro žáky
1) Doplňte pravou stranu reakcí a rovnice vyčíslete:
Al + CuSO4 →
Zn + CuSO4 →
Mg + CuSO4 →
2) Seřaďte měď, zinek, hliník a hořčík od nejreaktivnějšího po nejméně reaktivní.
3) Rozdělte tyto kovy na ušlechtilé a neušlechtilé.
1.6 Metodické poznámky
Příprava roztoku CuCl2:
Petriho misky mají různý využitelný objem, např. miska vnitřního průměru 11 cma výšky 19 mmpojme přes 100 cm3 roztoku. Na přípravu roztoku CuCl2 (w = 0,2) je spotřeba 20 g pro přípravu 100 cm3 roztoku. Rozpusťte 20 g soli v 50 cm3 destilované vody (můžete použít i vodu z kohoutku) a doplňte na objem 100 cm3.
Příprava roztoku HCl:
Roztok kyseliny chlorovodíkové nemusí mít přesné složení. K přípravě 50 cm3 cca 5% roztoku opatrně doplňte 42,5 cm3 vody v kádince roztokem koncentrované kyseliny (w = 35 %) na objem 50 cm3.
Žáci by měli mít k dispozici řadu napětí kovů, tato práce slouží k potvrzení pravidel, která v řadě napětí fungují. Vycházejte z Beketovovy řady kovů, zmiňte využití dějů, elektrochemickou korozi ap.



Poslední komentáře