Hliník, hořčík, zinek, měď – redoxní děje, pokyny pro učitele
autor red. | kategorie Chemie 2. stupeň ZŠ
1 Hliník, hořčík, zinek, měď – redoxní děje, laboratorní práce, pokyny pro učitele
Čas: 40 minut
1.2 Pomůcky a chemikálie
Petriho miska, kleště, kádinka s cca 5% roztokem HCl, hadřík nebo vata, vzorky kovů – granulky, plíšky nebo hobliny (Mg, Zn, Al), kádinka s 10% roztokem CuCl2, přesné váhy.
1.3 Princip
Při substitučních reakcích dochází k náhradě atomů nebo skupin atomů jiným atomem nebo skupinou. Substituční reakce se někdy označují jako vytěsňování. Hlavním úkolem této demonstrační úlohy je ukázat příklady jednoduchých substitučních dějů, vytěsňování ušlechtilého kovu neušlechtilým kovem v souladu s Beketovovou řadou kovů.
1.4 Postup
Pokud máte přesné váhy (přesnost na setiny gramu), zvažte si předem vzorky kovů.
- do tříčlenných skupin rozdá vyučující pomůcky pro laboratorní práci - každé skupině předá kádinku s roztokem chloridu měďnatého a vzorky kovů s poznamenanou hmotností, dále kádinku s roztokem HCl a hadřík
- popište skupinám, co přesně budou s pomůckami provádět
- na tabuli nebo na papír připravte řadu napětí kovů, aby ji při práci mohli žáci sledovat
- pomocí kleští ponoří na několik sekund žáci kovy (pouze Zn a Al!) do roztoku HCl a očistí je hadříkem
- žáci poté ponoří kovy (Mg, Al, Zn) do Petriho misek s nalitým roztokem CuCl2
- skupina pozoruje změny v roztoku a na povrchu kovu v něm ponořeném
- vycházejte z řady napětí (Beketovova řada kovů), komentujte využití dějů, elektrochemickou korozi
Po 10 minutách opatrně vyjměte kovy z roztoku, nechte je oschnout a podle situace je hned nebo druhý den zvažte. Prodiskutujte nárůst váhy a znatelné odbarvení roztoku chloridu měďnatého. Na závěr žáci odpoví na otázky.
1.5 Otázky a úkoly pro žáky
1) Žáci zapíšou rovnice probíhajících dějů a navrhnou jejich využití:
Cu2+ + Zn → ... + ...
Cu2+ + Mg → ... + ...
Cu2+ + Al → ... + ...
1.6 Metodické poznámky
Příprava roztoku CuCl2 pro substituční reakci:
Na přípravu roztoku CuCl2 (w = 0,1) je potřeba 10 g chloridu pro přípravu 100 cm3 roztoku. Rozpusťte 10 g soli ve 50 cm3 destilované vody (můžete použít i odstálou vodu z kohoutku) a doplňte na objem 100 cm3. S 5% roztokem HCl žáci mohou pracovat bez omezení.
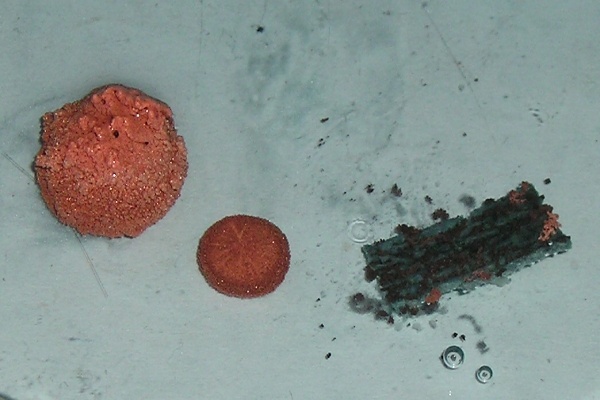
Tak jako na obrázku vypadá situace po přibližně 12 hodinách (hliníková granulka, zinková granulka, hoblinka hořčíku, zleva). Nicméně po vhození kovů do roztoku se velmi rychle tvoří na jejich povrchu pozorovatelná vrstva oranžovorůžové mědi. Pokud necháte kovy v roztoku ještě déle, reaguje hořčík za vzniku vodíku (obr. vpravo). Měď na jeho povrchu vytváří měděnku v důsledku interakce mědi s ionty OH-, stejně jako měď, která na obrázku vyčnívá nad hladinu roztoku na povrchu hliníku a zinku.




Poslední komentáře