Karboxylové kyseliny
autor red. | kategorie Chemie 2. stupeň ZŠ
1 Cíl
Žák je schopen prakticky prověřit vlastnosti kyseliny octové a aplikovat znalosti o vlastnostech kyseliny chlorovodíkové na organickou kyselinu. Dokáže porovnat obě kyseliny.
2 Úlohy
3 Vybrané vlastnosti kyseliny octové
3.1 Čas: 1 hodina
3.2 Pomůcky a chemikálie
Sada zkumavek, kádinky, laboratorní lžička, univerzální pH papírek, skleněná trubička, zátky, tyčinka, porcelánová miska, kahan, držák na zkumavky, ocet, fenolftalein, roztok NaOH, roztok HCl, hořčík, CaCO3, vzorek bílkoviny.
3.3 Princip
Kyselina octová CH3COOH je v porovnání s HCl slabší kyselinou, proto je hodnota pH vyšší. Reakce s kovy probíhá u organické kyseliny pomaleji a důkaz vznikajícího vodíku provedeme stejně jako při reakci s anorganickými kyselinami. S ušlechtilými kovy jako je měď nereaguje stejně jako anorganická kyselina HCl.
Reakcí s CaCO3 vytěsní stejně jako většina anorganických kyselin slabou kyselinu uhličitou (ve formě unikajícího CO2), protože kyselina octová je silnější než kyselina uhličitá.
3.4 Postup
1) Porovnejte reakci kyseliny octové (octa) a kyseliny chlorovodíkové
a) Do zkumavky dejte několik ml roztoku octa a do druhé stejný objem roztoku HCl.
b) Změřte univerzálním indikátorovým papírkem pH u obou roztoků a porovnejte.
c) K oběma kyselinám vhoďte měděný drátek a pozorujte.
d) Po skončení reakce z každé zkumavky odlijte asi 2 ml roztoku do porcelánové misky.
e) Opatrně zahřívejte a odpařte až téměř do sucha.
f) Připravte si další dvě zkumavky, opět jednu s octem a druhou s HCl.
g) Do každé zkumavky vhoďte kousek hořčíku a zazátkujte.
h) Po chvíli odzátkujte zkumavku s octem a přiklopte ji druhou zkumavkou otočenou dnem vzhůru.
i) Sledujte průběh reakce.
j) Proveďte důkaz vzniklého vodíku zkouškou v plameni.
k) Vše zaznamenejte do tabulky.
2) Prozkoumejte vybrané reakce kyseliny octové
a) Do zkumavky nalijte asi 5 ml octa.
b) Přisypte lžičku CaCO3.
c) Po chvíli vložte do kádinky nad hladinu reakční směsi hořící špejli.
d) Pozorujte a zaznamenejte do tabulky.
3) Proveďte neutralizaci kyseliny octové
a) K roztoku octa ve zkumavce přidejte pár kapek fenolftaleinu.
b) Po malých dávkách přikapávejte roztok NaOH.
c) Zamíchejte a pozorujte.
d) Roztok NaOH přidávejte tak dlouho, dokud nedojde k barevné změně.
4) Porovnejte rozpustnost kyseliny octové ve vodě a v ethanolu
a) Připravte si dvě kádinky s 10 – 15 ml octa.
b) Do jedné přidejte asi 10 ml vody a do druhé stejné množství ethanolu.
c) Zamíchejte a pozorujte.
3.5 Otázky a úkoly pro žáky
Úkoly:
1) Porovnej sílu obou kyselin a zapiš rovnicí jejich disociaci.
2) Napiš reakci hořčíku s oběma kyselinami.
3) Které látky jste získali na porcelánových miskách? Zapiš je názvem i vzorcem.
4) Vysvětli změnu plamene hořící špejle.
5) Napiš chemickou rovnici reakce kyseliny a uhličitanu.
6) Zapiš neutralizaci octa s NaOH chemickou rovnicí a pojmenuj vzniklé produkty.
Zapiš rovnicí uvedené chemické děje:
a) Disociace: CH3COOH + H2O …………………………………… + …………………………
b) Reakce s kovem: 2 CH3COOH + Mg ………………………………. + ………………
c) Reakce s uhličitanem: 2 CH3COOH + CaCO3 …………………………. + …………………. + H2O
d) Neutralizace: CH3COOH + NaOH …………………..…………. + …………….……………
|
|
pH |
Reakce s mědí |
Reakce s hořčíkem |
Zkouška v plameni |
Po přidání CaCO3 |
Vložení špejle |
|
ocet |
|
|
|
|
|
|
|
HCl |
|
|
|
|
----------- |
----------- |
3.6 Metodické poznámky
- Reakce s hořčíkem probíhá u kyseliny octové ve srovnání s HCl pomaleji a reakce s mědí neproběhne vůbec ani u jedné kyseliny.
- Po odpaření je v obou případech vidět odparek příslušné soli.
- Reakcí s CaCO3 vytěsní stejně jako většina anorganických kyselin slabou kyselinu uhličitou (ve formě unikajícího CO2), protože kyselina octová je silnější než kyselina uhličitá.
- Plamen hořící špejle v důsledku unikajícího CO2 zhasne.
- Fenolftalein se v přítomnosti kyseliny octové nijak nebarví. Přidáváním roztoku NaOH dochází k neutralizaci a první přebytek NaOH zbarví fenolftalein do fialova.
- Neutralizací vzniká octan sodný CH3COONa.
- Kyselina octová se rozpustí jak ve vodě, tak v ethanolu.
Poznámka:
- Lze ověřit i denaturační schopnosti octa na bílkoviny, např. na vaječný bílek.
Výsledky úkolů:
a) Disociace: CH3COOH + H2O CH3COO– + H3O+
a) Reakce s kovem: 2 CH3COOH + Mg (CH3COO)2Mg (octan hořečnatý) + H2
b) Reakce s uhličitanem: 2 CH3COOH + CaCO3 (CH3COO)2Ca + CO2 + H2O
c) Neutralizace: CH3COOH + NaOH CH3COONa + H2O (octan sodný)
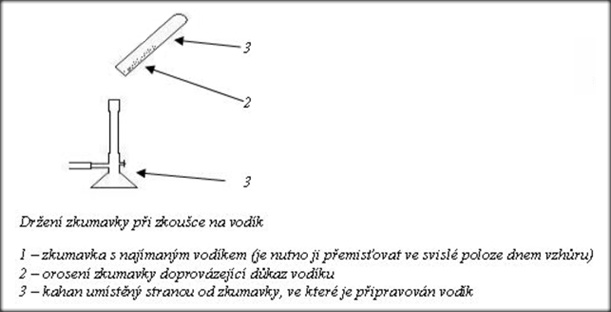
Důkaz vodíku
Vodík je nutno jímat do zkumavky otočené dnem vzhůru. Dokážeme jej přiložením ústí zkumavky k plameni (zvuková zkouška). Vodík shoří, přičemž se ozve charakteristický zvuk. Po shoření vodíku je na stěnách zkumavky patrná sražená vodní pára.
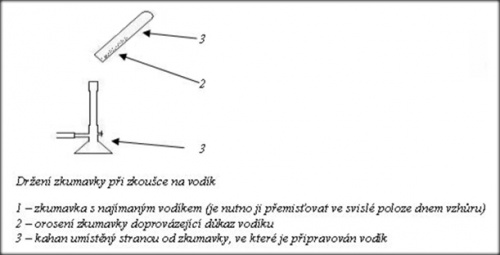
http://www.ped.muni.cz/wchem/sm/hc/labtech/pages/dukaz_vodiku.html
4 Literatura
1) Čtrnáctová, H. a kol.: Chemické pokusy pro školu a zájmovou činnost. Prospektrum, Praha 2000.



Poslední komentáře