Přípravy mědi

autor red. | kategorie Chemie 2. stupeň ZŠ
1 Přípravy mědi
Čas: elektrolýza - 30 minut
cementace - 40minut + minimálně denní interval na dekantaci
1.2 Pomůcky a chemikálie
roztok modré skalice (CuSO4, w = 20 %), práškový zinek, kádinka 500 cm3, magnetická míchačka, skleněná tyčinka, kyselina chlorovodíková (w = 14 %), lžička, kádinky 100 cm3, nálevka, skleněná tyčinka, skleněná U-trubice, vodiče pro připojení ke zdroji, 2 krokosvorky (nebo jiný úchytný mechanismus), 2 uhlíkové elektrody (lze použít i železné), zdroj stejnosměrného elektrického napětí (např. 9 V baterie), stojan, křížové svorky a držáky pro U-trubice ke stojanu, roztok chloridu měďnatého (CuCl2, w = 20 %), roztok kyseliny dusičné (w = 10 %)
1.3 Princip
Příprava mědi může probíhat různým způsobem. V našem případě využijeme jednoduché redoxní děje: vytěsňování ušlechtilého kovu neušlechtilým kovem v souladu s Beketovovou řadou kovů a elektrolýzu roztoku měďnaté soli.
1.4 Postup
Postup 1 Příprava mědi cementací
Práškovou měď připravíte reakcí vodného roztoku síranu měďnatého a práškového zinku. K 100 cm3 roztoku pentahydrátu síranu měďnatého v 500 cm3 kádince přidejte 10 g práškového zinku a po dobu asi 30 minut intenzivně míchejte na magnetické míchačce. Na konci vyučovací hodiny roztok slijte, dekantujte vodou a přidejte asi 100 cm3 roztoku kyseliny chlorovodíkové (w = 14 %), tím se zbavíte nezreagovaného zinku, který jste přidali v nadbytku. Druhý den roztok slijte, měď několikrát promyjte vodou, odsajte a sušte v exsikátoru za nepřístupu vzduchu (měď se na vzduchu oxiduje). V další vyučovací hodině na povrch vyloučené a usušené mědi na hodinovém sklíčku naneste jednu kapku zředěné kyseliny dusičné (w = 10 %). Kapka se zbarví modře vznikajícím dusičnanem měďnatým.
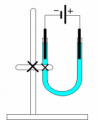
Postup 2 Příprava mědi elektrolýzou
Sestavte aparaturu podle obrázku. Aparatura je znázorněna tak, že katoda je vlevo, anoda vpravo. Do U trubice nalijte tolik roztoku chloridu měďnatého, aby po ponoření elektrod nevytekl elektrolyt, ale aby zbylo asi0,5 cmvolné trubice. Po zapojení svorek ke zdroji se na katodě začne vylučovat červený povlak mědi, zatímco na anodě se uvolňují bublinky chloru.

1.5 Otázky a úkoly pro žáky
1) Doplňte pravou stranu reakce a rovnice vyčíslete:
Zn + CuSO4 →
Zn + HCl →
2) Co se v první reakci redukuje a co se oxiduje
3) Přiřaďte měď a zinek mezi kovy ušlechtilé a neušlechtilé.
4) Co se v U trubici redukuje a v prostoru jaké elektrody, napiš rovnici děje.
5) Co se v U trubici oxiduje a v prostoru jaké elektrody, napiš rovnici děje.
1.6 Metodické poznámky
Příprava roztoku CuSO4 pro cementaci:
Pokud vyjdeme ze zadání, vychází na 100 cm3 roztoku přibližně 20 g soli. Rozpusťte tedy 20 g síranu v 80 cm3 vody. Bude to trvat asi pět minut při intenzívním míchání.
Při nasypání zinku do kádinky s roztokem modré skalice se směs rychle zahřeje, můžete komentovat exotermní děj. Pokud nemáte elektromagnetickou míchačku, míchejte směs průběžně celý den. Dekantaci můžete opakovat a nakonec přidat značné množství roztoku HCl (pro účely vymytí zinku stačí objemové ředění kyseliny 1:1 s vodou).
Tuto úlohu je nutno rozdělit na dvě části (do dvou vyučovacích hodin):
1. vlastní substituce (asi 35 minut po rozmíchání směsi a vyloučení červenohnědé mědi),
2. úprava produktů po dekantaci a důkaz mědi
Příprava roztoku CuCl2 pro elektrolýzu:
Na přípravu roztoku CuCl2 (w = 0,2) je spotřeba 20 g pro přípravu 100 cm3 roztoku. Rozpusťte 20 g soli ve 50 cm3 destilované vody (můžete použít i odstálou vodu z kohoutku) a doplňte na objem 100 cm3.
Elektrolýzu zapojte na nový článek, reakce bude probíhat zřetelněji a okamžitě. Vznikající chlor můžete dokázat jodidoškrobovým papírkem.





Poslední komentáře