Voda, roztoky, rozpustnost látek, nasycený roztok

autor red. | kategorie Chemie 2. stupeň ZŠ
1 Ověření vlivu teploty na rozpustnost látek
1.1 Pomůcky a chemikálie
5 zkumavek, trojnožka, síťka, kahan, kádinka, teploměr, váhy, lžička, filtrační aparatura, zápalky, dusičnan draselný KNO3, CaO, voda, šťavelan amonný,
1.2 Princip
Připravíme si přesycený roztok za normální teploty. Se stoupající teplotou se v daném objemu vody rozpouští další množství KNO3 a při ochlazení se nadbytečné množství opět vyloučí. Vyloučené množství KNO3 je po zchladnutí v jednotlivých zkumavkách stále větší. Naopak rozpustnost Ca (OH)2 je při vyšší teplotě menší, proto důkaz na přítomnost kationtů Ca2+ je méně výrazný.
1.3 Postup
Úkol 1: Ověřte vliv teploty na rozpustnost KNO3
- Připravte si 5 zkumavek a aparaturu na zahřívání
- Do kádinky odměřte asi 50 ml vody
- Navažte asi 75 g KNO3 a rozpusťte ho ve vodě.
- Určité množství soli zůstane nerozpuštěno.
- Směs zahřívejte a při teplotě40°Codeberte 5 ml roztoku do první zkumavky.
- Zahřívejte dále a při teplotě 60°C,80°C,100°Cpostupně odebírejte vždy 5 ml roztoku do jednotlivých zkumavek.
- Nechte vychladnout.
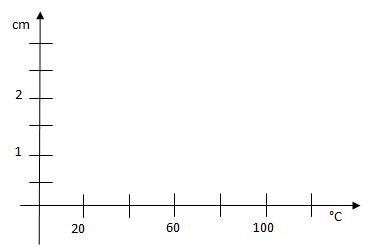
- Po zchladnutí zaznamenejte množství nerozpuštěné látky (změřte pravítkem výšku nerozpuštěné vrstvy) a vyneste do grafu.
Úkol 2: Ověřte rozpustnost Ca (OH)2 ve vodě.
- Rozpusťte lžičku CaO ve vodě
- Vzniklou suspenzi Ca (OH)2 rozdělte na dvě části
- Jednu část zfiltrujte do kádinky
- Druhou část krátce zahřejte a rychle zfiltrujte
- K oběma roztokům přidejte 2 – 3 kapky šťavelanu amonného
- Porovnejte množství vzniklé sraženiny
1.4 Otázky a úkoly pro žáky
1) Vypracujte na základě naměřených hodnot grafickou závislost rozpustnosti na teplotě.
graf:
2) Zapište rovnicí děj při rozpouštění CaO ve vodě.
CaO + H2O → Ca (OH)2
3) Jak byste dokázali, že roztok Ca (OH)2 má zásaditou reakci? (FFT zčervená)
4) Proč je množství vzniklé sraženiny šťavelanu vápenatého rozdílné? Jak byste zdůvodnili, že v jednom případě je množství sraženiny menší?
5) Najděte v literatuře informaci o kyselině šťavelové.
6) Napište aspoň tři způsoby, jakými můžete urychlit proces rozpouštění ve vodě.
(např. zvýšením teploty, mícháním, menší objem rozpouštěné látky, menší kousky rozpouštěné látky)
1.5 Metodické poznámky
Úkol 1:
Množství 75 g KNO3 je orientační (může být i více), viz tabulka rozpustnosti:
|
název |
0°C |
20°C |
60°C |
100°C |
|
KNO3 |
13g |
32g |
110g |
246g |
- Důležité je rozpustit takové množství KNO3,aby vzniklý roztok byl při normální teplotě přesycený, a aby byl přesycený aspoň při prvních teplotách odebírání.
- Se stoupající teplotou se v daném objemu vody rozpouští další množství KNO3 a při ochlazení se nadbytečné množství opět vyloučí.
- Vyloučené množství KNO3 je stále větší.
- vyloučený KNO3 tvoří krásně viditelné krystaly
Úkol 2:
Reakcí CaO s vodou vzniká málo rozpustný Ca(OH)2. Po přidání šťavelanu vzniká bílá sraženina šťavelanu vápenatého, který je ve vodě nerozpustný. Množství vzniklé sraženiny je závislé na přítomnosti kationtů Ca2+. Po přidání šťavelanu do roztoku, který byl zahříván, se vytvořilo méně sraženiny, protože Ca(OH)2 je ve vodě při vyšší teplotě hůře rozpustný.
2 Ověření vlivu vody jako rozpouštědla na rozpustnost látek
2.1 Pomůcky a chemikálie
Petriho misky (popř. zkumavky), odměrná zkumavka nebo válec, pinzeta, tyčinka, zátky, mouka, mletá paprika, strouhaná křída, olej, benzín, síra, ocet, …), jod, voda, ethanol, toluen, aceton, petrolej, kyselina octová, hexan (propan), benzín, chloroform, vodný roztok KI
2.2 Princip
Vlastnosti látek závisejí na druhu chemické vazby mezi částicemi, ze kterých se látky
skládají. Na základě znalosti chemické vazby můžeme předvídat jejich rozpustnost ve vodě nebo v jiných rozpouštědlech. Nepolární látky (nekovy, uhlovodíky) se
obvykle dobře rozpouštějí v nepolárních rozpouštědlech (benzen, toluen, sirouhlík aj.).
Polární a iontové látky (kyseliny, hydroxidy, soli aj.) se obvykle dobře rozpouštějí v polárních rozpouštědlech (voda, amoniak aj.). Iontové sloučeniny - např. sůl nebo manganistan jsou také velmi dobře rozpustné ve vodě, naopak v benzínu se téměř nerozpouští.
Voda je polární rozpouštědlo a jod je nepolární sloučenina. Jod je tedy ve vodě a jiných polárních rozpouštědlech velmi špatně rozpustný. Výbornou rozpustnost má v nepolárních a v organických rozpouštědlech, např. rozpustnost jodu v etanolu je mnohonásobně vyšší než ve vodě.
Barva rozpuštěného jodu je většinou hnědá, ale s některými rozpouštědly (CS2, CCl4, ...)
vzniká fialový roztok
2.3 Postup
Úkol 1: Porovnej rozpustnost vybraných vzorků ve vodě
- Připravte si 5 zkumavek a do každé nalijte asi 10 ml vody (zhruba do ¼).
- Postupně do jednotlivých zkumavek přidejte vybraný vzorek (pepř, strouhaná křída, olej, benzín, síra, ocet, …).
- Zazátkujte a důkladně protřepte.
- Výsledky pozorování zapište do tabulky 1.
Úkol 2 Porovnej rozpustnost jodu ve vodě a v jiných rozpouštědlech
- Na Petriho misky nalijte postupně cca 2 – 3 ml vzorků jednotlivých rozpouštědel.
- Zaznamenejte si jejich barvu.
- Ke každému rozpouštědlu přidejte pinzetou pár šupinek jodu.
- Opatrně tyčinkou promíchejte.
- Pozorujte rozpouštění a barvu vzniklých roztoků.
- Zaznamenejte do tabulky 2.
Úkol 3 Vytřepávání jodu z vodného roztoku
- Část vodného roztoku jodu (asi 2 ml) odlijte do 4 zkumavek.
- Přilijte opatrně stejný objem druhého rozpouštědla (ethanol, aceton, benzín,…). Do každé zkumavky jiné rozpouštědlo. Zazátkujte.
- Pozorujte a udělejte si barevný nákres
- Směs důkladně protřepejte.
- Výsledky pozorování zaznamenejte do tabulky 3.
2.4 Otázky a úkoly pro žáky
Tipněte si, jak se budou jednotlivé látky v úkolu 1 ve vodě rozpouštět a porovnejte svůj typ s realitou.
Co ovlivnilo rozpustnost jodu v konkrétních rozpouštědlech a proč je ve vodě nerozpustný?
Tabulka 1
|
voda + |
síra |
mletá paprika |
strouhaná křída |
ocet |
olej |
benzín |
|
tipování |
|
|
|
|
|
|
|
ano/ne/špatně |
|
|
|
|
|
|
Tabulka 2
|
|
voda |
líh |
benzín |
toluen |
aceton |
petrolej |
kyselina octová |
hexan |
|
barva před |
|
|
|
|
|
|
|
|
|
barva po |
|
|
|
|
|
|
|
|
|
rozpustnost ano / ne |
|
|
|
|
|
|
|
|
|
polarita rozpouštědla |
|
|
|
|
|
|
|
|
Tabulka 3
|
směs rozpouštědel |
rozpustnost |
barva směsi |
|
voda + jod+ ethanol |
|
|
|
voda + jod + aceton |
|
|
|
voda + jod + benzín |
|
|
1) Který roztok jodu se používá v lékařství a jaké má účinky?
2) Co tvoří spodní vrstvu v úkolu 3 a proč? Která vrstva obsahuje jod?
(spodní vrstva je vždy tvořena látkou s větší hustotou)
3) Rozpouští se látky ve vodě za různých podmínek stejně rychle?
(Ne. Rychlost rozpouštění látek je ovlivňována různými faktory např. teplotou.)
4) na jakém principu je založena metoda „vytřepávání neboli extrakce jako metoda oddělování složek směsi od sebe?
Pracovní list:
Zakroužkuj správné odpovědi na tyto otázky.
1) Jak poznáme, že je chemická látka ve vodě rozpustná?
a) Po určité době již nedokážeme zrakem odlišit, ze kterých látek se roztok skládá.
b) Po delší době dokážeme v nádobě okem rozlišit 2 různé látky.
c) Změní barvu.
2) Jak poznáme, že je pevná látka ve vodě nerozpustná?
a) Voda bude s pevnou látkou bouřlivě reagovat.
b) Barva vody se nezmění.
c) Pevná látka se ve vodě pouze rozptýlí a po určité době se opět usadí na dně.
3) Je SŮL ve vodě rozpustná? ANO NE
4) V jakém případě se pevná látka rychleji rozpustí? (Podtrhni správné tvrzení.)
Pokud:
a) ji necháme ve vodě v klidu. x ji budeme míchat.
b) ji nasypeme do teplé vody. x ji nasypeme do vody studené.
c) nasypeme do vody cukr krystal x nasypeme do vody moučkový cukr.
2.5 Metodické poznámky
Úkol 1:
Před prováděním pokusů mohou žáci tipovat, jak to bude vypadat s rozpustností u jednotlivých vzorků a na konci si ověřit správnost úvahy.
Tabulka 1
|
Voda + |
síra |
Paprika mletá |
Strouhaná křída |
Ocet |
Olej |
benzín |
|
tipování |
|
|
|
|
|
|
|
Ano/ne/špatně |
ne |
ne |
špatně |
ano |
ne |
ne |
Další vhodné látky: aceton, KMnO4, hexan, petrolej, toluen, naftalen, pepř, mletá paprika, puding, mouka, víno, džus, cukr krystal a cukr moučka (porovnat vliv velikosti) ….
Úkol 2
Lze použít i jiná rozpouštědla: chloroform, vodný roztok KI
Stejně tak se nemusí použít najednou všechna uvedená rozpouštědla
|
|
voda |
líh |
benzín |
toluen |
aceton |
petrolej |
kyselina octová |
hexan |
|
barva před |
bezbarvý |
bezbarvý |
bezbarvý |
bezbarvý |
bezbarvý |
bezbarvý |
bezbarvý |
bezbarvý |
|
barva po |
bezbarvý |
hnědý |
fialový |
hnědý |
hnědý |
fialový |
bezbarvý |
fialový |
|
rozpustnost ano / ne |
ne |
ano |
ano |
ano |
ano |
ano |
ne |
ano |
|
polarita rozpouštědla |
polární |
nepolární |
nepolární |
nepolární |
nepolární |
nepolární |
polární |
nepolární |
Úkol 3:
Po promíchání horní bezbarvá vrstva např. benzínu nebo cyklohexanu zfialoví, zatímco původní spodní vrstva (žlutohnědě zbarvený roztok jodu ve vodě) se odbarvil, neboť jod se extrahoval v benzínu, popř. v cyklohexanu. Dokázali jsme, že jod jako látka nepolární se lépe rozpouští v nepolárním rozpouštědle (cyklohexan) než v polárním (voda). Tato vlastnost látek se využívá při dělení nebo čištění směsí.
Vytřepávání je jedna z možných variant extrakce jako metody oddělování složek ze směsi látek. Extrakce je založena na rozdílné rozpustnosti extrahované látky ve dvou vzájemně nemísitelných rozpouštědlech, u kterých po nějaké době dojde k rozdělení obou vrstev na základě rozdílné hustoty rozpouštědel. Extrakci je možné opakovat použitím nové dávky extrahovala, a pokud potřebujeme složky od sebe oddělit, použijeme nejlépe dělící nálevku, která díky zúžené spodní části umožňuje přesné oddělení obou vrstev.
Další vhodná rozpouštědla pro extrakci jodu jsou: organická rozpouštědla např. benzen, toluen, CHCI3, CCl4...
Pro možné modifikace úlohy na rozpustnost lze prohlédnout velmi efektní pokus na odkazu Chemical Cocktail
http://www.chem-toddler.com/molecular-structure/chemical-cocktail.html (pokus s jódem a modrou skalicí, rozpouštědla: chloroform, voda, ethyl-acetát
3 Voda kyselá a zásaditá
3.1 Pomůcky a chemikálie
stojánek se zkumavkami, lakmusový papírek, univerzální indikátorový papírek, indikátor z kyselého zelí, methyloranž, minerální voda (různé druhy), voda z kohoutku, destilovaná voda misky (popř. zkumavky), odměrná zkumavka nebo válec, pinzeta, tyčinka, zátky
3.2 Postupy
Postup 1
Do čtyř zkumavek nalijte po 5 ml jednoho vzorku vody nebo minerálek. Ty nalévejte z čerstvě otevřených lahví, než vyprchá oxid uhličitý! Do jedné zkumavky vhoďte kousek lakmusového papírku, do druhé kousek univerzálního indikátorového papírku, do třetí nakapejte indikátor ze zelí a do čtvrté methyloranž (vždy asi 5 kapek). Pozorujte, jakou získají roztoky barvu. Změny zaznamenejte do tabulky a seřaďte druhy vody podle hodnoty pH na univerzálním indikátorovém papírku. Seřaďte je od nejnižší hodnoty – nejkyselejší, po nejvyšší – nejzásaditější. Nakonec přeměříme hodnotu pH pomocí měřící sady Vernier.
|
|
destilovaná voda |
voda z kohoutku |
voda … |
minerálka 1 |
minerálka 2 |
minerálka 3 |
|
UIP |
|
|
|
|
|
|
|
lakmus |
|
|
|
|
|
|
|
methyloranž |
|
|
|
|
|
|
|
indikátor ze zelí |
|
|
|
|
|
|
|
měření Vernier |
|
|
|
|
|
|
|
pořadí |
|
|
|
|
|
|
Postup 2
Postup opakujeme u minerálek poté, co z nich vyprchají bublinky oxidu uhličitého, to můžeme urychlit např. tím, že zkumavky ohřejeme. V tabulce výsledky obou testů porovnáme:
|
|
minerálka 1 |
minerálka 2 |
minerálka 3 |
|
UIP |
|
|
|
|
lakmus |
|
|
|
|
methyloranž |
|
|
|
|
indikátor ze zelí |
|
|
|
|
měření Vernier |
|
|
|
|
pořadí |
|
|
|
3.3 Otázky a úkoly pro žáky
Doplň text:
V obyčejné vodě se papírky nezměnily, v některé z minerálek zmodraly, je to tedy voda ……., v jiné zrůžověly, jedná se o ………… vodu. Indikátor ze zelí měl barvu…, methyloranž se změnila na… ve vzorku…
V některých z minerálek se pH posunulo po vyprchání oxidu uhličitého. Důvodem je ........., jedná se o ………… vodu. Indikátor ze zelí na změnu reagoval/nereagoval, protože ........., methyloranž se změnila ve vzorku ........., protože .......
4 Je voda elektrickým vodičem?
4.1 Pomůcky a chemikálie
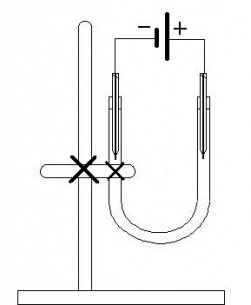
Široká kádinka 400 ml, skleněná U-trubice, dostatečně dlouhé vodiče pro připojení ke zdroji, 2 krokosvorky (nebo jiný úchytný mechanismus), uhlíkové elektrody, pokud je nemáme, můžeme použít upravené tužky (obrázek) nebo elektrody ze suchého článku, zdroj stejnosměrného elektrického napětí (např. 9 V baterie), stojan, křížové svorky a držáky pro U-trubice ke stojanu, kyselina chlorovodíková (HCl), destilovaná voda, voda z kohoutku, minerální voda, mořská nebo slaná voda…(můžeme použít i jiné vzorky vody)
4.2 Princip
O vodě se většinou tvrdí, že je elektrickým vodičem. Elektrická zařízení se nesmí hasit vodou. Do olověných akumulátorů se v minulosti dolévala voda, aby se lépe dobíjely. Suchý článek, když jej necháme dlouho ve spotřebiči, zvlhne a začne „téct“. Vypadá to jednoznačně. Pravda je ovšem složitější. Elektricky vodivé látky musí obsahovat volně pohyblivé, elektricky nabité částice, tzv. ionty. Množství těchto iontů je v čisté vodě velmi malé. K znatelnému přenosu elektrické energie samy o sobě nestačí. Na druhou stranu voda není nikdy ideálně čistou chemickou látkou. Vždy obsahuje nějaké nečistoty a ionty. Ty zlepšují transport energie. Elektrická vodivost vody závisí tedy na její čistotě. Čistota vody se měří pomocí elektrické vodivosti, čím nižší vodivost, tím je čistota vody větší. Vodivost vody můžeme zvýšit přidáním kyselin nebo jiných disociujících látek.
4.3 Postup
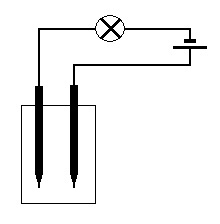
Do čisté kádinky nalijte destilovanou vodu. Připojte tužky špičkou ponořené do vody na vodiče, vodiče přes žárovku a nakonec k pólům baterie (obrázek). Tento postup opakujte s vodou z kohoutku, minerální vodou atd. Sledujte rozdíly ve svítivosti žárovky.
4.4 Metodické poznámky
Pokud je to možné, používejte při pokusu novou baterii. Buďte trpěliví, elektrolýza se nějakou dobu „rozbíhá“. Pokud provádíte pokus v U-trubici, dbejte na to, aby se elektrody nedotýkaly skla, stejně tak u kádinky.
5 Důkaz složení vody elektrolýzou
5.1 Pomůcky a chemikálie
skleněná U-trubice, dostatečně dlouhé vodiče pro připojení ke zdroji, 2 krokosvorky (nebo jiný úchytný mechanismus), uhlíkové elektrody, pokud je nemáme, můžeme použít upravené tužky (obrázek v předchozí úloze) nebo elektrody ze suchého článku, zdroj stejnosměrného elektrického napětí (např. 9 V baterie), stojan, křížové svorky a držáky pro U-trubice ke stojanu, kyselina chlorovodíková (HCl), destilovaná voda
5.2 Postup
Připravte elektrický obvod podle obrázku. Elektrody jsou stejné jako v předchozím úkolu, zdrojem je 9 V článek. Obvod je znázorněn tak, že katoda je vlevo, anoda vpravo. Do U trubice nalijte tolik destilované vody, aby po ponoření elektrod nevytekl elektrolyt, ale aby zbylo asi0,5 cmvolné trubice. Pokus můžete připravit také v kádince. K vodě přidejte předem pár kapek koncentrované kyseliny chlorovodíkové. Zapojte obvod a sledujte vývoj plynů. Porovnejte množství plynu na obou elektrodách. U záporné elektrody (katody) vzniká vodík a u kladné (anody) vzniká kyslík. Poměr plynů je 2:1.
5.3 Otázky a úkoly pro žáky
- Napište, na které elektrodě se vylučuje vodík a na které kyslík.
- Napište reakce, které vystihují děje na obou elektrodách.
- V jakém poměru jsou vodík a kyslík v molekule vody?
- Kterého z těchto plynů vzniká víc?
- Na které elektrodě probíhá redukce, na které oxidace?
5.4 Metodické poznámky
Pokud je to možné, používejte při pokusu novou baterii. Buďte trpěliví, elektrolýza se nějakou dobu „rozbíhá“. Pokud provádíte pokus v U-trubici, dbejte na to, aby se elektrody nedotýkaly skla, stejně tak u kádinky.
Řešení: 2H2O → O2 + 2H2 počet molů 1:2
katoda – redukce vodíku: 4 H+ + 4e– → 2 H2
anoda – oxidace kyslíku: 2 O2– – 4e– → O2




Poslední komentáře