Příprava a vlastnosti oxidu uhličitého
autor red. | kategorie Chemie Střední škola
1 Čas: 15 minut
2 Pomůcky a chemikálie
3 Princip
Uhličitany poskytují reakcí s kyselinou chlorovodíkovou oxid uhličitý. Oxid uhličitý je bezbarvý plyn, těžší než vzduch, nepodporuje hoření (hasí plamen). Po otočení válce díky své hustotě neuniká do okolí a drží se u dna nádoby. Důkaz nehořlavosti oxidu uhličitého lze provádět také pomocí hořící svíčky, kterou upevníme do kádinky (100 cm3) a zapálíme. Vznikající CO2 jímejte do kádinky v blízkosti hořící svíčky. Po přidání kyseliny z děličky se vznikající oxid bude hromadit v kádince. Když objem plynu vzroste na úroveň plamene svíčky, dojde k zhasnutí plamene.
Na2CO3 + 2 HCl → 2 NaCl + CO2 + H2O
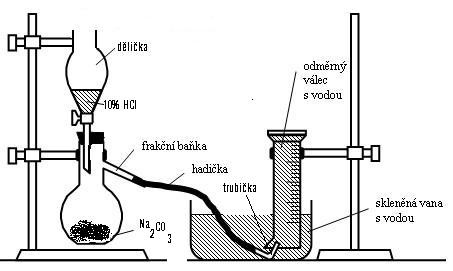
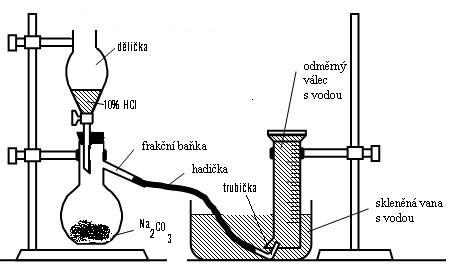
4 Postup
Sestavte aparaturu na jímání plynu podle obrázku. Do dělící nálevky nalijte 20 cm3 10% roztoku HCl a do frakční baňky navažte 3 g Na2CO3 a baňku uzavřete zátkou, kterou prochází stopka děličky. Do skleněné vany nalijte do poloviny jejího obsahu vodu. Odměrný válec naplňte až po okraj vodou, zakryjte rukou, obraťte a ponořte pod vodu ve vaně. Trubičku na konci hadičky zaveďte do válce. Pomalu přikapávejte z děličky HCl, která okamžitě reaguje s uhličitanem za vzniku bezbarvého CO2, který jímáme pneumaticky do odměrného válce. Po ukončení reakce (vyčerpání kyseliny nebo naplnění válce) válec uvolněte, rychle otočte a zasuňte do něj hořící špejli, která okamžitě zhasne.
5 Otázky a úkoly pro žáky
1) Napište reakci uhličitanu vápenatého s kyselinou chlorovodíkovou.
2) Co víš o oxidu uhličitém? Kterou vlastnost jsme tímto experimentem potvrdili?
6 Metodické poznámky
Lze provést také jako laboratorní práci s polovičním množstvím chemikálií a 5% HCl.



Poslední komentáře