Příprava vodíku elektrolýzou chloridu sodného
autor red. | kategorie Chemie Střední škola
1 Čas: 20 minut
2 Pomůcky a chemikálie
Malý hliněný květináč, vosk, krystalizační miska, uhlíková elektroda, ocelová elektroda, vodivý drát se svorkami, zdroj stejnosměrného elektrického proudu (2-3 ploché baterie), pipeta, balonek, nasycený roztok NaCl,roztok KI (w = 5 %), škrobový maz, fenolftalein.
3 Princip
2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2
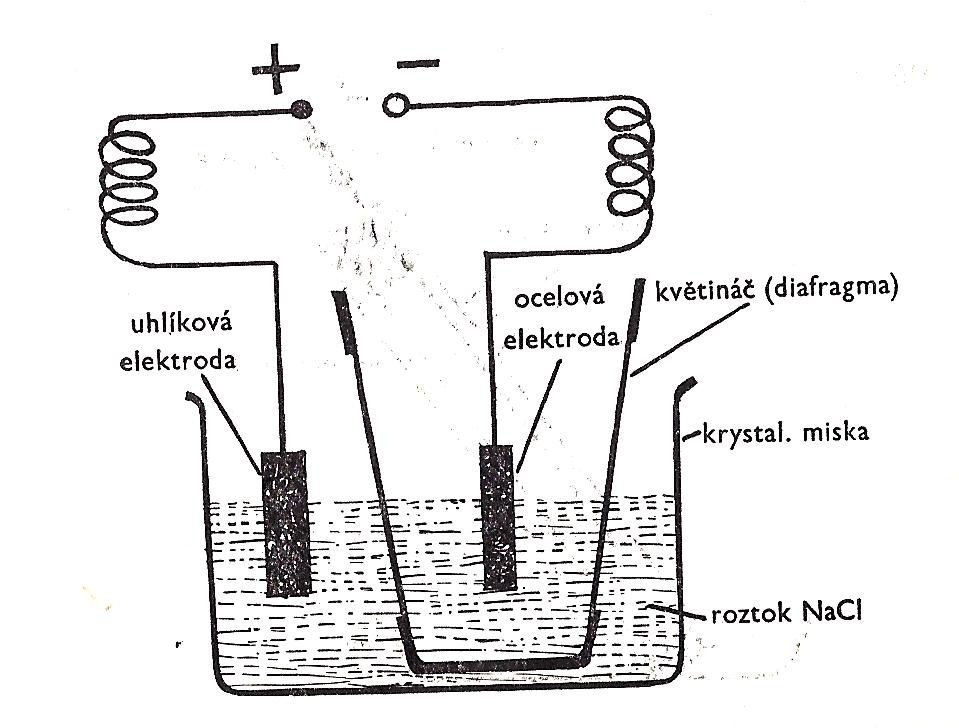
K provedení tohoto pokusu použijte malý hliněný květináč. Hliněná hmota zde bude fungovat jako diafragma. Umožní průchod elektrického proudu, ale neumožní smísení roztoků, oddělí prostor s jednotlivými elektrodami.
4 Postup
Otvor v květináči zalijte voskem a květináč ponořte do krystalizační misky s nasyceným roztokem chloridu sodného. Květináč naplňte asi do poloviny nasyceným roztokem chloridu sodného. Do roztoku v krystalizační misce ponořte uhlíkovou elektrodu a do roztoku v květináči elektrodu ocelovou (např. ocelový drát). K elektrodám připojte zdroj stejnosměrného elektrického proudu o napětí 9-12 V (2-3 ploché baterie spojené za sebou). Uhlík je anoda (+), ocel je katoda (-).
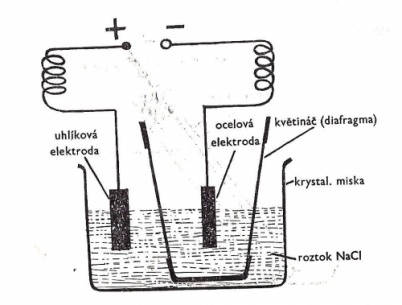
Elektrolýzu provádějte asi 5 minut a pak odpojte. Z krystalizační misky pak odsajte pipetou s balonkem trochu roztoku a dejte ho do zkumavky. Přidejte k němu 3 cm3 5% roztoku jodidu draselného. Protřepejte a přidejte pár kapek škrobového mazu. Do roztoku v květináči přidejte pár kapek roztoku fenolftaleinu.
Pozorování: Ve zkumavce se objeví modré zabarvení. Roztok v květináči se zbarví růžovofialově.
Vysvětlení: Při elektrolýze vznikl na anodě chlor a rozpustil se ve vodě. Tento roztok reagoval s jodidem draselným. Vznikl jod, jehož přítomnost byla dokázána škrobem. Růžovofialové zabarvení roztoku v květináči je důkazem přítomnosti hydroxidu. Při elektrolýze zde vznikl hydroxid sodný a na elektrodě se vyloučil vodík.
5 Otázky a úkoly pro žáky
1) Zapište rovnice reakcí probíhající na elektrodách
2) Zapište rovnice následných reakcí probíhajících v soustavě (reakce chloru, reakce sodíku) a vysvětlete barevné změny v roztocích.
6 Metodické poznámky
- uhlíkovou elektrodu lze získat ze staré vybité ploché baterie, jako ocelovou elektrodu lze použít drát
- při dobře sestavené aparatuře reakce probíhá snadno a rychle



Poslední komentáře