Příprava vodíku elektrolýzou vody
autor red. | kategorie Chemie Střední škola
1 Čas: 15 minut
2 Pomůcky a chemikálie
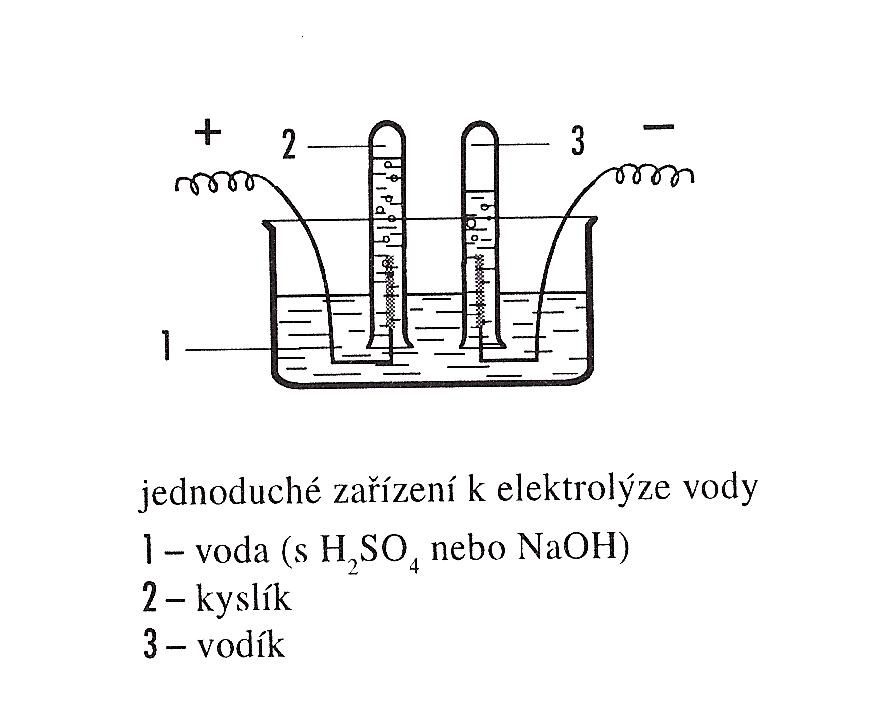
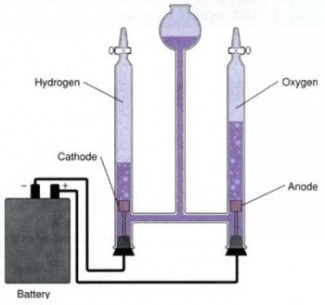
K pokusu použijte elektrolyzér, např. Hofmannův přístroj nebo si sestavte vlastní aparaturu: Jako elektrody můžete použít uhlík z vybité ploché baterie. Vodivé dráty se svorkami. Kádinka, zkumavky, 2 ploché baterie (nebo zdroj stejnosměrného proudu), kahan, voda, roztok H2SO4 nebo NaOH (w = 10 %).
3 Princip
2 H2O → 2 H2 + O2
Na katodě (záporná elektroda) vzniká vodík, na anodě (kladná elektroda) se vylučuje kyslík. Objemy plynů jsou v poměru 2:1. Určité množství vzniklého kyslíku se rozpouští ve vodě, tudíž objem vzniklého vodíku se může jevit více než dvojnásobný.
k: 4 H3O+ + 4 e–→ 2 H2 + 2 H2O
Použijeme-li roztok zředěné kyseliny sírové probíhá na anodě reakce:
a: 2 SO42–+ H2O – 4 e- → O2 + 2 H2SO4
Použijeme-li roztok hydroxidu sodného, probíhá na anodě reakce:
a: 4 OH–– 4 e–→ O2 + 2 H2O
4 Postup
Zkumavky naplňte vodou, upevněte vedle sebe do držáků na stojanu dnem vzhůru, vsuňte pod ně elektrody a to vše umístěte do velké kádinky s vodou. K uhlíkatým elektrodám připojte plochou baterii – zdroj stejnosměrného elektrického proudu o napětí min 4,5 V. Přidáním zředěné kyseliny sírové či roztoku hydroxidu sodného průběh pokusu urychlíte.
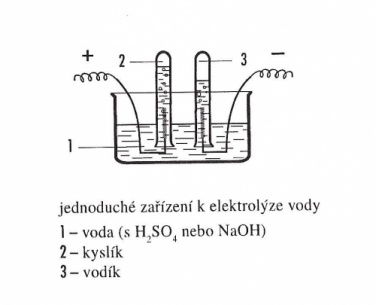
Hofmannův přístroj
Důkaz vodíku: Zkumavku po naplnění vodíkem přeneste v poloze dnem vzhůru k plameni kahanu a ústí hned dejte k plameni. Pokud nevnikl do zkumavky vzduch, vodík shoří. Pokud tam vnikl vzduch, projeví se reakce typickým „štěknutím“, tj. reakce třeskavé směsi vodíku s kyslíkem.
Pozorování: V obou zkumavkách vzniká bezbarvý plyn. Porovnejte rozdíl objemů a zdůvodněte, v které zkumavce vzniká vodík a ve které kyslík.
Poznámka: Zředěná kyselina sírová na katodě uvolňuje vodík a na anodě radikály SO4 reagují s vodou, vzniká kyselina sírová a uvolňuje se kyslík, takže se rozkládá voda.
5 Otázky a úkoly pro žáky
1) Kolik dm3 vodíku a kyslíku za s.p. vznikne z 32 cm3 vody?
2) Kolik mol a kolik dm3 plynů celkem vznikne z 10 mol vody?



Poslední komentáře