Různé postupy vedou k chloru
autor red. | kategorie Chemie Střední škola
1 Čas: 30 minut
2 Pomůcky a chemikálie
Zkumavky, zátky na zkumavky, váhy, lžička, kádinky 100 cm3, hodinové sklíčko, váhy, nálevka, skleněná tyčinka, zápalky, skleněná U-trubice, dostatečně dlouhé vodiče pro připojení ke zdroji, 2 krokosvorky (nebo jiný úchytný mechanismus), 2 uhlíkové elektrody (lze použít i železné), zdroj stejnosměrného elektrického napětí (např. 9 V baterie), stojan, křížové svorky a držáky pro U-trubice ke stojanu, manganistan draselný (KMnO4), oxid manganičitý (MnO2), kyselina chlorovodíková (HCl), chlorid sodný (NaCl), chlorid měďnatý (CuCl2), destilovaná voda, fenolftalein, roztok škrobu, (digestoř).
3 Princip
Halogeny můžeme připravit oxidací halogenidů, jejich nejběžnějších solí a oxidací halogenovodíkových kyselin. Chlor nejčastěji připravujeme oxidací kyseliny chlorovodíkové oxidačními činidly nebo oxidací chloridů např. elektrolýzou.
4 Postup
1. příprava chloru oxidací kyseliny chlorovodíkové: Do dvou zkumavek nasypte po cca 0,1 g jednoho z těchto dvou oxidačních činidel: manganistan draselný (KMnO4) a oxid manganičitý (MnO2). Ke každému činidlu přidejte 2 cm3 koncentrované kyseliny chlorovodíkové (HCl). Do ústí zkumavky zasuňte jodidoškrobový papírek navlhčený vodou a zajistěte jej pryžovou zátkou. Vznik chloru potvrdí jodidoškrobový papírek, zmodrá.
rovnice:
MnO2 + 4 HCl → MnCl2 + 2 H2O + Cl2
2 KMnO4 + 16 HCl → 2 MnCl2 + 2 KCl + 8 H2O + 5 Cl2
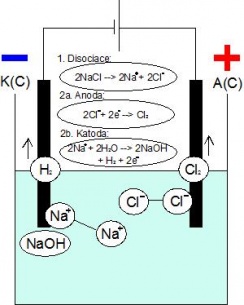
2. příprava chloru elektrolýzou roztoku NaCl:
Aparatura:
Sestavte aparaturu podle obrázku. Aparatura je znázorněna tak, že katoda je vlevo, anoda vpravo. Do U trubice nalijte tolik roztoku, aby po ponoření elektrod nevytekl elektrolyt, ale aby zbylo asi0,5 cmvolné trubice. Po připojení elektrod ke zdroji začne elektrolýza a na elektrodách dochází ke změnám.

3. příprava chloru elektrolýzou CuCl2:
Aparatura:
Sestavte aparaturu podle obrázku. Aparatura je znázorněna tak, že katoda je vlevo, anoda vpravo. Do U trubice nalijte tolik roztoku, aby po ponoření elektrod nevytekl elektrolyt, ale aby zbylo asi0,5 cmvolné trubice.
5 Otázky a úkoly pro žáky
1) Vysvětlete změnu barvy jodidoškrobového papírku při indikaci produktu v přípravě chloru oxidací HCl.
2) Napište rovnice chemických reakcí přípravy chloru z chloridu elektrolýzou. Pojmenujte elektrodu, na které se chlor uvolňuje.
6 Metodické poznámky
Příprava elektrolytu roztoku NaCl:
Pro pokus je nejvhodnější nasycený roztok halogenidu. Nejpoužívanější střední U-trubice mají využitelný objem cca 13 cm3. Hmotnostní zlomek nasyceného roztoku pro NaCl je 0,26 (spotřebujeme cca 2,8 g). Do připraveného roztoku můžete rovnou přidat cca 0,5 cm3 fenolftaleinu pro indikaci zásaditého prostředí v okolí katody.
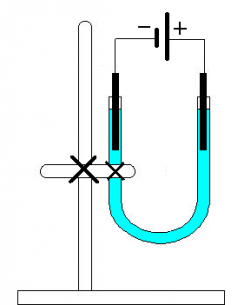
Příprava elektrolytu CuCl2:
Pro pokus je nejvhodnější nasycený roztok halogenidu. Rozpouštějte postupně chlorid měďnatý v kádince do té doby, pokud se rozpouští. Pak slijte roztok do jiné kádinky a nerozpuštěnou sůl dejte stranou.
Chlor je velmi jedovatý, leptá sliznice, poškozuje plíce! Pokusy s chlorem provádějte v digestoři nebo zajistěte řádné větrání učebny. Přebytečný chlor odstraňujte, např. jeho reakcí s roztokem sody



Poslední komentáře