Fázový diagram vody

autor Mgr. Josef Veselý | kategorie Fyzika Střední škola
1. Úkol: Ověření fázového diagramu vody
Čas: 2 vyučovací hodiny
Pomůcky a materiál: Vývěva s manometrem, kádinka, teploměr, dvě misky, kostičky ledu, 6x PET lahev s ledem, dvě tenké struny, jedna silnější struna, 4x závaží 3 až 5 kg, 2x závaží 5 až 8 kg.
Hlavní a dílčí cíle:
Pochopení fázového diagramu vody a možnosti jeho ověřování.
Uvědomit si význam mimořádných vlastností vody v přírodě a její význam pro vznik a udržení života.
Mezipředmětové vztahy a přesahy:
biologie, ekologie, zeměpis, astronomie
Klíčové kompetence: Rozvíjíme kompetence k učení a řešení problémů.
2. Obecný úvod k tématu:
Voda (H2O) je látka výjimečných vlastností, které mají zásadní vliv na vznik a udržování života na Zemi. Velká měrná tepelná kapacita stabilizuje v přírodě teplotu. Anomálie vody například umožňuje přezimování vodních živočichů. Menší hustota ledu v porovnání s vodou udržuje průtočnost zamrzlých toků, sněhová pokrývka chrání zem před promrzáním a podobně. Hlubší pochopení těchto vlastností a jejich souvislostí nám umožní podrobné prostudování fázového diagramu.
Fázový diagram vody je p-t diagram, ve kterém je znázorněn stav látky (zde H2O) v závislosti na tlaku p a teplotě t. Na ose p je obvykle logaritmická stupnice.
Diagram je rozdělen na tři pole podle skupenství, jsou v něm zakresleny tři křivky: křivka tání oddělující pevné a kapalné skupenství, křivka syté páry oddělující skupenství kapalné a plynné a křivka sublimační oddělující pevné a plynné skupenství. Dále obsahuje dva význačné body: trojný bod T a kritický bod K.
Trojný bod představuje jedinou dvojici teploty a tlaku, při kterých mohou být v rovnováze všechna tři skupenství. Kritický bod je dán maximální teplotou, při které ještě může být látka v kapalném stavu. Při této teplotě se vyrovná hustota kapaliny a její syté páry.
Křivka tání je obvykle rostoucí, jen pro vodu je klesající. Znamená to, že u vody se s rostoucím tlakem teplota tání snižuje.
Obr. 1 - fázový diagram vody
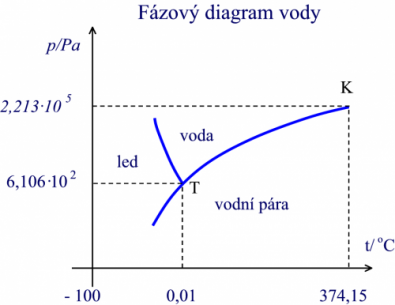
Poznámky k obrázku:
Na vodorovné ose je znázorněna teplota od – 100°C do 374,15°C. Při vyšší teplotě již neexistuje tekutá voda, může být jen vodní pára. Na svislé ose je zobrazen tlak v pascalech. Stupnice je zde logaritmická.
3. Pracovní postup (v bodech):
Ověření snižování teploty tání při zvyšování tlaku:
- V PET lahvích necháme zmrznout vodu
- Mezi dvě lavice položíme dva dřevěné metry
- Strunou spojíme dvě stejná závaží
- Ve zúženém místě odřízneme plast z láhve
- PET láhev položíme na dřevěné metry a přes obnažený led zavěsíme strunu se závažími, na podlahu pod láhev dáme lavor s molitanem nebo jinou měkkou látkou pro ztlumení nárazu padajících závaží
- Měříme čas potřebný k proříznutí ledu
Měření teploty varu vody za sníženého tlaku
- Kádinku s vodou a teploměrem vložíme pod recipient vývěvy
- Zapneme odsávání
- Pozorujeme teploměr a manometr
- Odečteme teplotu a tlak, při kterých nastal var, a zapíšeme do tabulky
- Pokus opakujeme s vodou o jiné teplotě
Vysvětlení pokusu:
Na základě měření zjišťujeme, že voda může vařit i za nižšího tlaku než 100°C. Teplota varu vody se s klesajícím tlakem také zmenšuje.
Pozorování sublimace
- Jednu misku s kostkou ledu položíme na stůl, druhou vložíme pod recipient vývěvy
- Zapneme odsávání, udržujeme tlak na určité úrovni
- Pozorujeme led na obou miskách, měříme dobu potřebnou pro roztáni nebo vysublimování ledu
- Pokus opakujeme za jiného tlaku
Vysvětlení a průběh pokusu:
Led v misce na stole se nejprve ohřívá na teplotu tání (což nevidíme) a další teplo získávané tepelnou výměnou s okolním vzduchem a podložkou způsobuje tání ledu.
Led pod recipientem vývěvy se také ohřívá, ale zároveň sublimuje. Pozorujeme zmenšování objemu ledu, aniž vzniká odpovídající množství vody.
4. Metodické poznámky
- Pokus s regelací ledu je třeba zahájit vždy na začátku hodiny, je třeba počítat s delším průběhem.
- Trojný bod udává nejnižší tlak, při kterém může látka existovat v kapalném skupenství.
- Kritický bod udává nejvyšší teplotu, při kterém může látka existovat v kapalném skupenství.
- Křivka tání je klesající pro látku, která má v pevném skupenství menší hustotu než ve skupenství kapalném. Za zvýšeného tlaku se látka „snaží“ zaujmout to skupenství, ve kterém má větší hustotu.
- U fázového diagramu je na ose „p“ vhodné použít logaritmickou stupnici, abychom rozlišili rozdíly mezi malými tlaky a aby se do obrázku vešly i tlaky velké.
- Sestrojený graf můžeme porovnat s grafem uvedeným v MFCHT.
5. Očekávané výstupy RVP SV:
Žák: na základě provedených měření a pozorování lépe pochopí a zapamatuje si fázový diagram vody, lépe porozumí mimořádným vlastnostem vody a jejímu významu v přírodě a ve vesmíru.

 Doprovodné otázky pro studenty, kvízy, úkoly aj.
Doprovodné otázky pro studenty, kvízy, úkoly aj.

Poslední komentáře